Présentation au congrès annuel 2015 de l`ASCO de résultats qui

Communiqué de presse
_______________________________________________________________________________
POUR DIFFUSION IMMÉDIATE
Relations avec
les médias :
Annick Robinson
438 837-2550
Relations avec les
investisseurs :
Justin Holko
908 740-1879
Présentation au congrès annuel 2015 de l’ASCO de résultats qui étoffent les
données sur le pembrolizumab : activité anti-tumorale maintenant démontrée
contre 13 types différents de tumeurs
Présentation au congrès de l’ASCO des nouvelles données sur divers cancers difficiles à
traiter, notamment les cancers du poumon à petites cellules, de l’œsophage et de l’ovaire
Études d’homologation en cours pour le pembrolizumab dans le traitement de huit types
différents de tumeurs
Kirkland, Québec, le 3 juin 2015 – Merck (NYSE : MRK), connue sous le nom de MSD à
l’extérieur du Canada et des États-Unis, a annoncé la première présentation des résultats tirés
de l’étude de phase 1b KEYNOTE-028 portant sur l’utilisation du pembrolizumab, le traitement
anti-PD-1 de l’entreprise, chez des patients atteints de divers cancers difficiles à traiter,
notamment le cancer du poumon à petites cellules (CPPC), le cancer de l’œsophage et le
cancer de l’ovaire de stade avancé. Ces données, présentées lors du 51e congrès annuel de
l’American Society of Clinical Oncology (ASCO) tenu à Chicago du 29hici au 2 juin 2015,
proviennent du programme de développement clinique en immuno-oncologie d’envergure et à
croissance rapide de Merck pour le pembrolizumab.
« L’ampleur et l’importance des données communiquées lors du congrès de l’ASCO
étayent le potentiel de l’activité clinique étendue du pembrolizumab dans le traitement de divers
cancers », a déclaré le Dr Roy Baynes, vice-président principal et directeur du processus
mondial de développement clinique, Laboratoires de recherche de Merck. « Notre objectif est
d’aider les personnes atteintes de cancer et ces données nous permettent de mieux
comprendre quels patients sont plus susceptibles de bénéficier de notre traitement anti-PD-1. »
Lors du congrsonnes ’ASCO, les donnonnes atteintes de cancer et ’activites donnonnes
le du pembrolizumab contre 13mabnonnes le dintes de cancer et ces donné’homologation

- 2 -
prmologation prnnes le dintes de cancer et ces données nous permettent de mieux comprendre
quels patients sont plus suscept’autres mtion prnnes
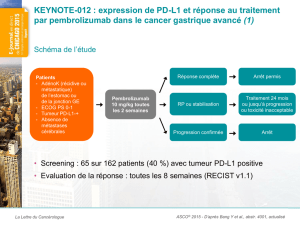
À propos de l’étude de phase 1b KEYNOTE-028
L’étude KEYNOTE-028, en cours, est un essai « panier » ou « basket » de phase 1b,
sans répartition aléatoire et constituée de plusieurs cohortes visant à évaluer l’innocuité, le profil
de tolérance et l’activité anti-tumorale du pembrolizumab en monothérapie (à raison de
10 mg/kg toutes les deux semaines) chez plus de 450 patients atteints de 20 cancers différents.
L’étude a évalué des patients atteints d’une tumeur solide de stade avancé exprimant le PD-L1
qui n’ont pas répondu au traitement actuel ou chez qui le traitement actuel n’est pas approprié.
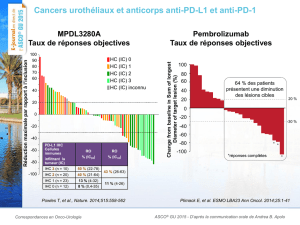
Résultats préliminaires tirés de la cohorte de patients atteints d’un cancer du poumon à
petites cellules de stade avancé (résumé no 7502)
Ces résultats préliminaires recueillis auprès de 20 patients lourdement prétraités,
atteints d’un cancer du poumon à petites cellules de stade avancé, et présentés le samedi
30 mai par le Dr Patrick Ott, du Dana-Farber Cancer Institute, ont révélé un taux de réponse
globale (réponses confirmées ou non confirmées) de 35 % (n = 7/20) [IC à 95 % : 15 à 59]
(selon les critères RECIST 1.1). Au moment de l’analyse, la réponse au traitement était toujours
en cours chez six des sept patients présentant une réponse. La durée médiane du suivi chez
les patients évaluables était de 21 semaines (intervalle : 2 à 48). Les effets indésirables étaient
conformes aux données déjà rapportées sur l’innocuité du pembrolizumab. Des effets
indésirables liés au traitement (survenant chez au moins deux patients) ont été observés chez
14 patients. Les effets indésirables liés au traitement de grades 3 et 4, selon l’évaluation faite
par les chercheurs, étaient les suivants : asthénie (n = 1) et augmentation du taux sanguin de
bilirubine (n = 1). Des patients ont présenté des effets indésirables d’intérêt particulier,
notamment une thyroïdite auto-immune (n = 1, grade 2) et une colite (n = 1, grade 5). Il y a eu
un décès lié au traitement (colite).
Résultats préliminaires tirés de la cohorte de patients atteints d’un cancer de l’œsophage
de stade avancé (résumé no 4010)
Ces résultats préliminaires recueillis auprès de 23 patients lourdement prétraités,
atteints d’un cancer de l’œsophage de stade avancé, et présentés lors d’un symposium en
sciences cliniques le dimanche 31 mai par le Dr Toshihiko Doi, du
National Cancer Center Hospital East, à Kashiwa, au Japon, ont révélé un taux de réponse

- 3 -
globale (réponses confirmées ou non confirmées) de 30,4 % (n = 7/23) [IC à 95 % : 13,2 à 52,9]
(selon les critères RECIST 1.1). Le taux de réponse globale était de 29,4 % (n = 5/17) chez les
patients atteints d’un carcinome épidermoïde et de 40 % (n = 2/5) chez ceux atteints d’un
adénocarcinome. La durée médiane de la réponse au traitement était de 40 semaines (0,1+ à
40), la réponse étant toujours en cours chez six des sept patients présentant une réponse. Une
réduction du volume de la tumeur a été obtenue chez 52,2 % des patients évaluables. Les
effets indésirables étaient conformes aux données déjà rapportées sur l’innocuité du
pembrolizumab. Des effets indésirables liés au traitement (survenant chez au moins deux
patients) ont été observés chez neuf patients. Tous les effets indésirables liés au traitement,
selon l’évaluation faite par les chercheurs, étaient de grade 3 et comprenaient une diminution
du nombre de lymphocytes (n = 2), une diminution de l’appétit (n = 1), un trouble hépatique
(n = 1) et une éruption cutanée prurigineuse (n = 1). Des patients ont présenté des effets
indésirables d’intérêt particulier (grade 2), notamment l’hypothyroïdie (n = 2) et une insuffisance
surrénalienne (n = 1). Aucun décès associé au traitement n’est survenu.
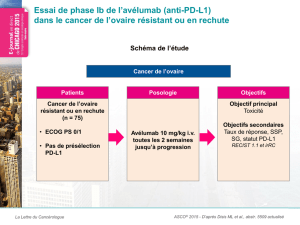
Résultats préliminaires tirés de la cohorte de patientes atteintes d’un cancer de l’ovaire
de stade avancé (résumé no 5510)
Ces résultats préliminaires recueillis auprès de 26 patientes lourdement prétraitées,
atteintes d’un cancer de l’ovaire de stade avancé, qui ont été présentés lors d’un symposium en
sciences cliniques le lundi 1er juin par la Dre Andrea Varga, de l’Institut Gustave Roussy, à
Villejuif, en France, ont révélé un taux de réponse globale (réponses confirmées ou
non confirmés) de 11,5 % (n = 3/26) [IC à 95 % : 2,4 à 30,2] (selon les critères RECIST 1.1). En
outre, le taux de maîtrise de la maladie était de 34,6 % (n = 9/26) [IC à 95 % : 17,2 à 55,7]. Au
moment de l’analyse, la durée médiane de la réponse au traitement n’avait pas encore été
atteinte (27,9 à 36,3). Une réduction du volume de la tumeur a été obtenue chez 23 % des
patientes évaluables. Les effets indésirables étaient conformes aux données déjà rapportées
sur l’innocuité du pembrolizumab. Des effets indésirables liés au traitement (survenant chez au
moins deux patientes) ont été observés chez 18 patientes. Un effet indésirable lié au traitement
de grades 3 et 4 est survenu (élévation du taux de transaminases). Des patientes ont présenté
des effets indésirables d’intérêt particulier, notamment l’hyperthyroïdie (n = 2), l’hypothyroïdie
(n = 3), la myosite (n = 1) et la pancréatite (n = 1). Aucun décès lié au traitement n’est survenu.

- 4 -
À propos du cancer du poumon
Le cancer du poumon, qui se développe dans les tissus des poumons, habituellement
dans les cellules tapissant les conduits aériens, est la principale cause de décès lié au cancer
dans le monde. Il y a deux principaux types de cancer du poumon : celui que l’on appelle « non
à petites cellules (CPNPC) » et celui dit « à petites cellules (CPPC) ». En 2012, 1,8 million de
nouveaux cas de cancer du poumon auraient été diagnostiqués à l’échelle mondiale. Le CPPC
représente environ de 10 à 15 % de tous les cas de cancer du poumon.
À propos du cancer de l’œsophage
Le cancer de l’œsophage est un type de cancer qui prend naissance dans la couche
interne (muqueuse) de l’œsophage et se propage vers l’extérieur. Il y a deux principaux types
de cancer de l’œsophage : le carcinome épidermoïde et l’adénocarcinome. En 2012, le nombre
de nouveaux cas de cancer de l’œsophage et le nombre de décès causés par cette maladie ont
respectivement été estimés à 456 000 et à 400 000 à l’échelle mondiale, ce qui en fait le
huitième cancer le plus répandu.
À propos du cancer de l’ovaire
Le cancer de l’ovaire est un type de cancer qui prend naissance dans les ovaires. Il y a
trois principaux types de tumeurs ovariennes : les tumeurs épithéliales, les tumeurs germinales
et les tumeurs stromales. En 2012, le nombre de nouveaux cas de cancer de l’ovaire et le
nombre de décès causés par cette maladie ont respectivement été estimés à 239 000 et à
152 000 à l’échelle mondiale.
À propos du PD-L1 et de l’expression du PD-L1
Le PD-L1, également appelé « ligand 1 de mort cellulaire programmée », est une
protéine qui est exprimée sur de nombreux types de cellules, dont certaines cellules
cancéreuses. Dans des conditions normales, l’interaction du PD-L1 avec une autre protéine,
appelée « récepteur 1 de mort cellulaire programmée (PD-1) », est un important point de
contrôle immunitaire, qui assure le maintien du système immunitaire et qui empêche
l’organisme de détruire ses propres cellules si une inflammation ou une infection survient.
Toutefois, lorsque les tumeurs cancéreuses expriment le PD-L1, elles sont en mesure
d’échapper à la détection et à la destruction par les lymphocytes T cytotoxiques – un type de
cellules du système immunitaire qui détruisent les cellules cancéreuses – permettant ainsi à la
tumeur de survivre et se développer. L’expression de PD-L1 par les cellules tumorales a été

- 5 -
observée à différents degrés dans de nombreux types de cancers, notamment le cancer du
sein, du poumon et de la vessie. L’expression accrue de PD-L1 par les cellules tumorales fait
l’objet d’une analyse en vue de son utilisation potentielle pour aider à identifier les patients plus
susceptibles de répondre à certaines immunothérapies.
À propos du pembrolizumab
Le pembrolizumab agit en aidant le système immunitaire à combattre le cancer. C’est un
anticorps de haute affinité dirigé contre le récepteur 1 de mort cellulaire programmée (PD-1). En
inhibant la liaison du récepteur PD-1 à ses ligands, le pembrolizumab réactive les
lymphocytes T cytotoxiques spécifiques à la tumeur dans le microenvironnement tumoral ce qui,
par conséquent, réactive l’immunité anti-tumorale.
Au Canada, le pembrolizumab n’est indiqué que pour le traitement du mélanome
non résécable ou métastatique et dans les cas d’évolution de la maladie à la suite d’un
traitement avec l’ipilimumab et, en présence d’une mutation V600 du gène BRAF, à la suite d’un
traitement avec un inhibiteur du gène BRAF ou MEK1. Le pembrolizumab a été approuvé au
Canada le 19 mai 2015 en vertu de la politique sur les Avis de conformité avec conditions (AC-
C) sur la base de données cliniques prometteuses et en attendant les résultats d’études
permettant d’attester les bienfaits cliniques du produit.
Merck mène un programme de développement clinique d’envergure et à croissance
rapide pour le pembrolizumab. En effet, ce programme compte plus de 100 études cliniques –
portant sur plus de 30 types de tumeurs et regroupant plus de 16 000 patients – qui évaluent le
médicament tant en monothérapie qu’en association avec d’autres traitements.
Notre intérêt pour le cancer
Notre objectif est de traduire les percées scientifiques en médicaments novateurs pour
le traitement du cancer dans le but d’aider les personnes atteintes de cancer partout dans le
monde. Chez Merck Oncologie, aider à lutter contre le cancer est une passion, favoriser l’accès
à nos médicaments contre le cancer est un engagement et poursuivre la recherche en immuno-
oncologie est un idéal, et nous accélérons chaque étape du processus – du laboratoire à la
clinique – pour offrir un nouvel espoir aux personnes aux prises avec un cancer. Pour obtenir un
complément d’information sur nos essais cliniques en oncologie, visitez le site à l’adresse
www.merck.com/clinicaltrials.
 6
6
 7
7
1
/
7
100%