Le pembrolizumab de Merck se révèle supérieur à la chimiothérapie

Communiqué de presse
____________________________________________________________________________
Relations avec les
médias :
Annick Robinson
438-837-2550
Relations avec les
investisseurs :
Justin Holko
908-740-1879
Le pembrolizumab de Merck se révèle supérieur à la chimiothérapie en ce qui concerne la
survie globale chez les patients atteints d’une forme avancée de cancer du poumon non à
petites cellules ayant déjà été traités et dont les tumeurs expriment le PD-L1
KIRKLAND, Québec, le 28 octobre 2015 – Merck (NYSE : MRK), connue sous le nom de MSD à l’extérieur
du Canada et des États-Unis, a annoncé aujourd’hui les principaux résultats de l’étude KEYNOTE-010, qui
visait à évaluer l’efficacité du pembrolizumab chez les patients atteints d’une forme avancée de cancer du
poumon non à petites cellules (CPNPC), confirmant ainsi que l’étude avait atteint son objectif principal.
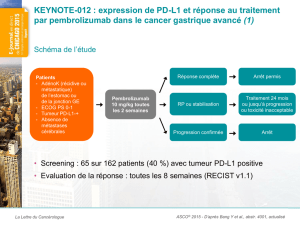
L’étude KEYNOTE-010 est une étude pivot de phases 2 et 3, menée avec répartition aléatoire et visant
à comparer deux doses de pembrolizumab (une dose de 2 mg/kg et une plus élevée, de 10 mg/kg, chacune
administrée toutes les trois semaines) au docetaxel, une chimiothérapie couramment utilisée. Les patients
admis à l’étude étaient atteints d’une forme avancée de CPNPC et n’avaient pas répondu à un traitement
systémique antérieur. Chez ces patients, le pourcentage des cellules tumorales exprimant le marqueur PD-L1
(ligand 1 de mort cellulaire programmée) était d’au moins 1 %. Les résultats ont été évalués chez les patients
dont les tumeurs étaient classées comme exprimant fortement le PD-L1 (le pourcentage de cellules tumorales
exprimant le marqueur PD-L1 étant d’au moins 50 %), ainsi que chez tous les patients dont les cellules
tumorales exprimaient le PD-L1.
Une analyse a révélé que le traitement avec le pembrolizumab a été associé à une survie globale (SG)
plus longue, comparativement au docetaxel. Cela s’est avéré pour les deux doses de pembrolizumab, qui ont
démontré la même efficacité. Ce fait a également pu être observé, tant dans le premier groupe de patients
analysés – ceux chez qui le pourcentage de cellules tumorales exprimant le marqueur PD-L1était d’au moins
50 % – que parmi tous les patients admis à l’étude, lesquels affichaient un pourcentage de cellules tumorales
exprimant le marqueur PD-L1 d’au moins 1 %).
Le traitement avec le pembrolizumab, aux deux doses, s’est également avéré supérieur au docetaxel
en ce qui a trait à la survie sans progression (SSP) chez les patients dont le pourcentage de cellules tumorales
exprimant le marqueur PD-L1 était égal ou supérieur à 50 %. En ce qui a trait à la SSP, le traitement avec le
pembrolizumab s’est révélé supérieur numériquement, mais non statistiquement, au traitement avec le
docetaxel dans le groupe composé de patients dont les tumeurs étaient classées comme exprimant le PD-L1,
et ce, aux deux doses également. Dans cette étude, le profil d’innocuité du pembrolizumab concorde avec

- 2 -
celui obtenu au cours d’études rapportées antérieurement et menées auprès de patients atteints d’une forme
avancée de CPNPC.
« Les résultats de cette étude s’ajoutent au nombre croissant de données appuyant le potentiel du
pembrolizumab dans le traitement du cancer du poumon non à petites cellules », a déclaré le
Dr Roger M. Perlmutter, président, Laboratoires de recherche de Merck. « Améliorer la norme thérapeutique
dans le traitement du cancer exige un effort de collaboration, et nous sommes reconnaissants envers les
patients, les établissements et les soignants qui ont participé à cette étude. Nous nous réjouissons à l’idée de
pouvoir partager nos données complètes avec la communauté scientifique et les organismes de
réglementation dans un proche avenir. »
À propos de l’étude KEYNOTE-010
KEYNOTE-010 est une étude pivot internationale de phases 2 et 3, avec répartition aléatoire, menée
au su (ClinicalTrials.gov, NCT01905657) visant à évaluer l’efficacité de deux doses de pembrolizumab
(2 mg/kg ou 10 mg/kg toutes les trois semaines), comparativement au docetaxel (75 mg/m2 toutes les trois
semaines) chez 1 034 patients atteints d’un CPNPC dont la maladie a évolué après un traitement systémique
à base de platine et dont les tumeurs exprimaient le PD-L1. Les paramètres principaux étaient la SG et la
SSP. La réponse tumorale était évaluée à la semaine 12, puis toutes les 6 semaines par la suite, au moyen
d’une évaluation centralisée indépendante effectuée par radiographie et à l’insu, conformément aux
critères RECIST 1.1 et aux critères de réponse liés au système immunitaire, selon l’évaluation faite par les
chercheurs.
À propos de KEYTRUDA® (pembrolizumab) au Canada
Le pembrolizumab, connu sous le nom de marque KEYTRUDA®, est un anticorps monoclonal
humanisé qui bloque l’interaction entre le PD-1 et ses ligands, le PD-L1 et le PD-L2. En se liant au récepteur
PD-1 et en bloquant l’interaction avec ses ligands, le pembrolizumab lève l’inhibition de la réponse immunitaire
médiée par le PD-1, y compris la réponse immunitaire antitumorale. Au Canada, l’utilisation de KEYTRUDA® a
été approuvée pour le traitement de patients atteints d’un mélanome non résécable ou métastatique avec
évolution de la maladie à la suite d’un traitement avec l’ipilimumab et, en présence d’une mutation V600 du
gène BRAF, à la suite d’un traitement avec un inhibiteur du gène BRAF ou de la protéine MEK. Une
amélioration de la survie ou une réduction des symptômes de la maladie n’ont pas encore été établies.
KEYTRUDA® a reçu une autorisation de commercialisation avec conditions, en attendant les résultats d’études
permettant d’attester son bénéfice clinique.
Merck mène un programme de développement clinique d’envergure et à croissance rapide qui s’est
rapidement élargi pour inclure plus de 30 types de tumeurs dans plus de 130 études cliniques, dont plus de
70 portent sur l’association du pembrolizumab à d’autres traitements contre le cancer.

- 3 -
À propos du cancer du poumon
Le cancer du poumon, qui se développe dans les tissus des poumons, habituellement dans les cellules
tapissant les conduits aériens, est la principale cause de décès lié au cancer dans le monde. Chaque année,
un plus grand nombre de personnes meurent du cancer du poumon que du cancer du côlon, du sein et de la
prostate combinés. Il y a deux types de cancer du poumon : celui que l’on appelle « non à petites cellules
(CPNPC) » et celui dit « à petites cellules (CPPC) ». Le CPNPC est le type de cancer du poumon le plus
répandu et compte pour environ 85 % de tous les cas. On estime à 4 % le taux de survie relative après 5 ans
pour les cas de cancer du poumon à un stade très avancé ou métastatique (stade IV).
Le cancer du poumon est le type de cancer le plus souvent diagnostiqué au Canada (à l’exception des
cancers de la peau autres que le mélanome). Au Canada, il s’agit de la principale cause de décès lié au
cancer, et ce, tant chez les hommes que chez les femmes. On estime qu’en 2015, 26 600 Canadiens
recevront un diagnostic de cancer du poumon. Cela représente 14 % de tous les nouveaux cas de cancer. On
estime également que 20 900 Canadiens mourront d’un cancer du poumon. Cela représente 27 % de tous les
décès par cancer.
En 2015, on estime que, chaque jour, en moyenne, 73 Canadiens recevront un diagnostic de cancer du
poumon, et que 57 Canadiens mourront d’un cancer du poumon1.
Notre intérêt pour le cancer
Notre objectif est de traduire les percées scientifiques en médicaments novateurs pour le traitement du
cancer dans le but d’aider les personnes atteintes de cancer partout dans le monde. Chez Merck Oncologie,
aider à lutter contre le cancer est une passion, favoriser l’accès à nos médicaments contre le cancer est un
engagement et poursuivre la recherche en immuno-oncologie est un idéal, et nous accélérons chaque étape
du processus – du laboratoire à la clinique – pour offrir un nouvel espoir aux personnes aux prises avec un
cancer. Pour obtenir un complément d’information sur nos essais cliniques en oncologie, visitez le site à
l’adresse www.merck.com/clinicaltrials.
À propos de Merck Canada
La société Merck d’aujourd’hui est un chef de file mondial dans le domaine des soins de santé qui
œuvre au bien-être du monde. Merck est connue sous le nom de MSD à l’extérieur des États-Unis et du
Canada. Grâce à nos médicaments d’ordonnance, nos vaccins et nos traitements biologiques de même qu’à
nos produits de santé animale, nous collaborons avec nos clients et œuvrons dans plus de 140 pays à
procurer des solutions de santé novatrices. Nous démontrons également notre détermination à améliorer
l’accès aux soins de santé grâce à des politiques, programmes et partenariats d’envergure. Pour de plus
amples renseignements à propos de nos activités au Canada, visitez le site à l’adresse www.merck.ca.

- 4 -
Déclarations prospectives de Merck & Co., Inc., Kenilworth, N.J., États-Unis
Ce communiqué de Merck & Co., Inc., Kenilworth, N.J., États-Unis (la « Société ») contient des
« déclarations prospectives » (forward looking statements), au sens des dispositions libératoires de la Private
Securities Litigation Reform Act de 1995 des États-Unis. Ces déclarations sont fondées sur les convictions et
les prévisions actuelles de la direction de la Société et sont soumises à de nombreux risques et incertitudes.
Rien ne garantit que les produits au stade expérimental reçoivent les approbations nécessaires des
organismes de réglementation ou qu’ils auront un succès commercial. Si les postulats comptables se révèlent
inexacts ou en cas de risques ou d’incertitudes, les résultats réels peuvent différer de façon appréciable de
ceux que décrivent les déclarations prospectives.
Les risques et les incertitudes comprennent, sans s’y limiter, les conditions générales du secteur et la
concurrence; les facteurs économiques généraux, y compris le taux d’intérêt et les fluctuations du taux de
change; les effets de la réglementation de l’industrie pharmaceutique ou des lois concernant les soins de la
santé aux États-Unis et à l’échelle mondiale; les tendances mondiales en matière de limitation des coûts de
soins de santé; les percées technologiques et les nouveaux produits des concurrents ainsi que les brevets
obtenus ces derniers; les défis inhérents à la mise au point des nouveaux produits, y compris l’obtention de
l’approbation réglementaire; la capacité de la Société à prédire précisément les conditions de marché futures;
les difficultés ou les retards liés à la fabrication; l’instabilité financière des économies mondiales et le risque
pays; la dépendance à l’égard de l’efficacité des brevets de la Société et des autres protections relatives aux
produits innovants, ainsi que le risque de faire l’objet d’actions judiciaires, y compris les litiges sur les brevets,
ou de mesures réglementaires.
La Société ne s’engage aucunement à publier des mises à jour de ses déclarations prospectives à la
suite de nouveaux renseignements, d’événements futurs ou de quelque fait que ce soit. D’autres facteurs
susceptibles d’entraîner une différence notable entre les résultats réels et les résultats décrits dans les
déclarations prospectives sont énoncés dans le rapport annuel 2014 de la Société établi sur le formulaire 10-K
et dans les autres documents déposés par la société auprès de la Securities and Exchange Commission
(SEC) des États-Unis et accessibles sur le site Internet de cette dernière (www.sec.gov).
# # #
1 La Société canadienne du cancer, Cancer du poumon https://www.cancer.ca/fr-ca/cancer-information/cancer-
type/lung/statistics/?region=on , consulté le 26 octobre 2015.
Veuillez consulter la monographie de KEYTRUDA (pembrolizumab) à l’adresse
http://www.merck.ca/assets/fr/pdf/products/KEYTRUDA-PM_F.pdf.
1
/
4
100%