Lors du San Antonio Breast Cancer Symposium 2014, Merck

Communiqué de presse
____________________________________________________________________________________
Relations avec
les médias :
Annick Robinson
(514) 837-2550
Relations avec les
investisseurs :
Joseph Romanelli
(908) 740-1986
Stephanie Lyttle
Le Cabinet de relations
publiques NATIONAL
(514) 843-2365
Justin Holko
(908) 740-1879
Lors du San Antonio Breast Cancer Symposium 2014, Merck annonce des
données positives concernant l’utilisation du pembrolizumab chez des patientes
atteintes d’un cancer du sein triple négatif à un stade avancé
Un taux de réponse global de 18,5 % a été observé chez les patientes présentant cette forme
agressive de cancer du sein et traitées avec le pembrolizumab
Une étude de phase 2 est prévue au cours du premier semestre 2015 (KEYNOTE-086)
Kirkland, Québec, le 10 décembre 2014 – Merck, connue sous le nom de MSD à l’extérieur
du Canada et des États-Unis, a annoncé aujourd’hui les premiers résultats d’une étude portant
sur le pembrolizumab démontrant un taux global de réponse de 18,5 % (n = 5/27) chez des
patientes atteintes d’un cancer du sein triple négatif à un stade avancé exprimant le PD-L1,
l’une des formes les plus agressives de cancer du sein. Le pembrolizumab est le traitement
anti-PD-1 expérimental de Merck.
Au moment de l’analyse, la durée médiane de la réponse au traitement n’avait pas
encore été atteinte chez trois des cinq patientes traitées depuis au moins 11 mois (plage : 15 à
40 semaines et plus). Ces résultats préliminaires, issus de l’étude KEYNOTE-012 de phase 1b
(en cours), ont été communiqués pour la première fois aujourd’hui dans le cadre du programme
officiel du San Antonio Breast Cancer Symposium 2014 (SABCS) (résumé no S1-09) et feront
l’objet d’une présentation orale par la Dre Rita Nanda, de l’Université de Chicago, à 10 h 45
(HNC).
« Le cancer du sein métastatique triple négatif est une forme de cancer agressive et
souvent difficile à traiter, a affirmé la Dre Rita Nanda, directrice associée du programme de
dépistage du cancer du sein de l’Université de Chicago et investigatrice principale dans le cadre
de l’étude de cohorte de phase 1b portant sur l’efficacité du pembrolizumab dans le traitement
du cancer du sein triple négatif. Les résultats présentés cette année au SABCS, bien qu’ils

- 2 -
soient préliminaires, démontrent une activité antitumorale prometteuse chez ces patientes qui,
pour la plupart, ont déjà subi plusieurs chimiothérapies. »
« Cette année, Merck a fait progresser considérablement son programme de
développement en immuno-oncologie et de nouveaux résultats concernant le pembrolizumab
ont été présentés au sujet de sept différents types de cancer, y compris ces premières données
relatives au cancer du sein triple négatif, a déclaré la Dre Alise Reicin, vice-présidente, Activités
mondiales de développement clinique, Oncologie, Laboratoires de recherche Merck. Ces
données préliminaires sur le pembrolizumab indiquent que des patientes atteintes de l’une des
formes les plus agressives du cancer du sein ont obtenu une réponse au traitement, ce qui
nous permet de mieux comprendre le rôle de la voie PD-1 dans le traitement de cette maladie.
Notre étude de phase 2, qui devrait être menée au cours de la première moitié de l’année 2015,
constituera une importante étape à franchir dans le cadre de notre programme clinique sur le
cancer du sein. »
Premiers résultats sur l’efficacité du pembrolizumab dans le traitement du cancer du sein
triple négatif de stade avancé
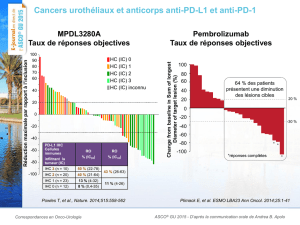
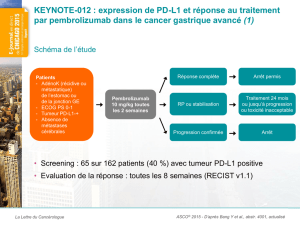
Les données présentées ont été tirées de l’analyse d’une cohorte de l’étude KEYNOTE-
012 de phase 1b (en cours), qui visait à évaluer l’administration du pembrolizumab en
monothérapie à raison de 10 mg/kg toutes les deux semaines chez des patientes atteintes d’un
cancer du sein triple négatif de stade avancé exprimant le PD-L1 (n = 32), tel que confirmé par
un test d’immunohistochimie exclusif de Merck conçu pour les études cliniques. Les tumeurs
des patientes étaient classées comme exprimant le PD-L1 si au moins un pour cent des cellules
tumorales exprimaient le marqueur PD-L1 ou si un résultat positif était obtenu à la coloration du
stroma tumoral avec le même réactif. Dans le cadre de cette étude, 58 % des patientes ayant
subi un dépistage présentaient une tumeur exprimant le PD-L1. La plupart des femmes inscrites
à cette étude avaient déjà reçu au moins deux chimiothérapies afin de traiter un cancer
métastatique, et 87,5 % d’entre elles avaient reçu un traitement néoadjuvant ou adjuvant
antérieur.

- 3 -
Activité antitumorale avec le pembrolizumab selon les critères d’évaluation RECIST 1.1
(Response Evaluation Criteria in Solid Tumours v1.1)*
Patientes évaluables sur le plan de la
réponse (n = 27)
a
Taux de réponse global, n (%)
5 (18,5 %)
Meilleure réponse globale, n (%)
• Réponse complèteb
1 (3,7 %)
• Réponse partielleb
4 (14,8 %)
• Maladie stable
7 (25,9 %)
• Maladie évolutive
12 (44,4 %)
• Aucune évaluationc
3 (11,1 %)
* Date limite de l’analyse : le 10 novembre 2014.
a Comprend les patientes présentant une maladie mesurable au départ qui ont reçu au moins une dose de pembrolizumab et qui ont
subi au moins une tomodensitométrie suivant l’observation initiale ou qui ont cessé leur traitement avant la première
tomodensitométrie en raison de l’évolution de leur maladie ou d’un effet indésirable lié au traitement. Cinq patientes ont été exclues
de l’étude, car elles n’ont pas fait l’objet d’une évaluation centralisée (n = 2) ou parce qu’elles n’avaient pas une maladie mesurable
selon une évaluation centralisée au début de l’étude (n = 3).
b Réponses confirmées seulement.
c « Aucune évaluation » s’applique dans le cas de patientes ayant abandonné le traitement avant la première tomodensitométrie
suivant l’observation initiale en raison d’une maladie évolutive ou d’un effet indésirable lié au traitement.
Le délai médian avant la réponse au traitement a été de 18 semaines (plage : 7 à
32 semaines). Dans le cadre de cette étude, une régression de la tumeur a été observée chez
33 % des patientes ayant reçu le pembrolizumab. Après six mois, le taux de survie sans
progression avec le pembrolizumab était de 23,3 %.
Les effets indésirables étaient conformes aux données déjà rapportées sur l’innocuité du
pembrolizumab. Les effets indésirables liés au traitement le plus souvent rapportés (c.-à-d. chez
au moins 5 % des patientes) étaient les suivants : arthralgie (n = 6), fatigue (n = 6), myalgie (n =
5), nausées (n = 5), augmentation de l’ALAT (n = 2), augmentation de l’ASAT (n = 2), diarrhée
(n = 2), érythème (n = 2) et céphalées (n = 2). Les effets indésirables liés au traitement de
grades 3 à 5 sont survenus chez cinq des patientes, et ils comprenaient l’anémie, une
coagulation disséminée intravasculaire, les céphalées, la méningite aseptique, une diminution
de la fibrinogénémie et la pyrexie. Deux patientes ont interrompu le traitement avec le
pembrolizumab en raison d’effets indésirables. Un décès lié au traitement a été rapporté chez
une patiente présentant une évolution rapide de la maladie; le décès est attribuable à une
coagulation disséminée intravasculaire accompagnée d’une thrombocytopénie et d’une
diminution de la fibrinogénémie.

- 4 -
À propos de l’étude KEYNOTE-012
L’étude KEYNOTE-012, en cours, est une étude multicentrique de phase 1b sans
répartition aléatoire visant à évaluer l’innocuité, la tolérance et l’activité antitumorale du
pembrolizumab en monothérapie chez des patients atteints de formes avancées des cancers
suivants : cancer du sein triple négatif, cancer de la tête et du cou, cancer urothélial (vessie) ou
cancer de l’estomac. Les principaux paramètres d’évaluation de l’étude comprennent le profil
global d’innocuité et de tolérance ainsi que l’activité antitumorale (d’après les critères
RECIST 1.1 et selon une évaluation radiologique réalisée de façon indépendante) dans les
tumeurs dont l’expression du PD-L1 a été confirmée. Les paramètres d’évaluation secondaires
comprennent la survie sans progression de la maladie, la survie globale et la durée de la
réponse. En 2014, les premiers résultats ont été présentés pour les quatre cohortes de l’étude
KEYNOTE-012 de phase 1b.
À propos du pembrolizumab
Le pembrolizumab est le traitement anti-PD-1 expérimental de Merck. Le
pembrolizumab fait actuellement l’objet d’une évaluation relativement à plus de 30 types de
cancers, en monothérapie et en association avec d’autres agents anticancéreux.
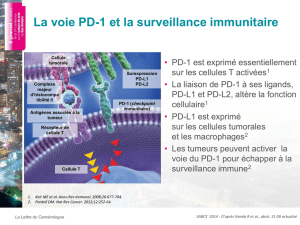
Le pembrolizumab est un anticorps monoclonal humanisé qui bloque l’interaction entre
le PD-1 et ses ligands, le PD-L1 et le PD-L2. En se liant au récepteur PD-1 et en bloquant
l’interaction avec ses ligands, le pembrolizumab lève l’inhibition de la réponse immunitaire
médiée par la voie PD-1, y compris la réponse immunitaire antitumorale.
À propos du cancer du sein
Le cancer du sein est une tumeur maligne qui prend naissance dans les cellules du
sein1. À l’échelle mondiale, le cancer du sein est le type de cancer le plus fréquent chez les
femmes. Au total, 1,67 million de nouveaux cas auraient été diagnostiqués en 20122. Le cancer
du sein occupe le 5e rang parmi les causes les plus fréquentes de décès lié au cancer dans le
mondeError! Bookmark not defined.. Le cancer du sein triple négatif est une forme agressive de
cancer du sein; les cellules cancéreuses sont dépourvues de récepteurs d’œstrogènes et de
progestérone, et elles ne surexpriment pas HER2, une protéine favorisant la croissance3.
Environ 15 % à 20 % des cas de cancer du sein sont dits triple négatifs4.
On estime à 24 400 le nombre de Canadiennes qui recevront un diagnostic de cancer
du sein en 2014. Cela représente 26 % de tous les nouveaux cas de cancer chez les femmes
cette année. De plus, on estime que 5 000 femmes mourront du cancer du sein au Canada en

- 5 -
2014. Cela représente 14 % de tous les décès attribuables au cancer chez les femmes cette
année. En moyenne, tous les jours, 67 Canadiennes reçoivent un diagnostic de cancer du sein
et 14 mourront de cette maladie. En 2014, 210 Canadiens recevront un diagnostic de cancer du
sein et cette maladie causera la mort de 60 d’entre eux5.
Notre intérêt pour le cancer
Notre objectif est de traduire les percées scientifiques en innovations biomédicales pour
aider les personnes atteintes du cancer partout dans le monde. Chez Merck Oncologie, aider à
lutter contre le cancer est une passion, favoriser l’accès à nos médicaments contre le cancer
est un engagement et poursuivre la recherche en immuno-oncologie est un idéal pour apporter
de l’espoir aux personnes qui sont atteintes d’un cancer. Pour obtenir un complément
d’information sur nos essais cliniques en oncologie, visitez le site à l’adresse
www.merck.com/clinicaltrials.
À propos de Merck
La société Merck d’aujourd’hui est un chef de file mondial dans le domaine des soins de
santé qui oeuvre au bien-être du monde. Merck est connue sous le nom de MSD à l’extérieur
du Canada et des États-Unis. Grâce à nos médicaments d’ordonnance, nos vaccins et nos
traitements biologiques de même qu’à nos produits de santé grand public et de santé animale,
nous collaborons avec nos clients et oeuvrons dans plus de 140 pays à procurer des solutions
de santé novatrices. Nous démontrons également notre détermination à améliorer l’accès aux
soins de santé grâce à des politiques, programmes et partenariats d’envergure. Pour obtenir un
complément d’information sur nos activités au Canada, visitez le site à l’adresse www.merck.ca.
Déclarations prospectives
Ce communiqué contient des « déclarations prospectives » (forward looking
statements), au sens des dispositions libératoires de la Private Securities Litigation Reform Act
de 1995 des États-Unis. Ces déclarations sont fondées sur les convictions et les prévisions
actuelles de la direction de Merck et sont soumises à de nombreux risques et incertitudes. Si
les postulats comptables se révèlent inexacts ou en cas de risques ou d’incertitudes, les
résultats réels peuvent différer de façon appréciable de ceux que décrivent les déclarations
prospectives.
Les risques et les incertitudes comprennent, sans s’y limiter, les conditions générales du
secteur et la concurrence; les facteurs économiques généraux, y compris le taux d’intérêt et les
 6
6
1
/
6
100%