Cancer de l`ovaire résistant ou en rechute

La Lettre du CancérologueLa Lettre du Cancérologue
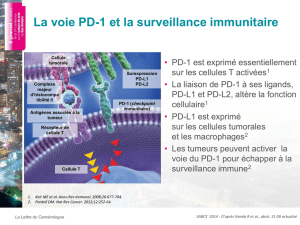
Essai de phase Ib de l’avélumab (anti-PD-L1)
dans le cancer de l’ovaire résistant ou en rechute
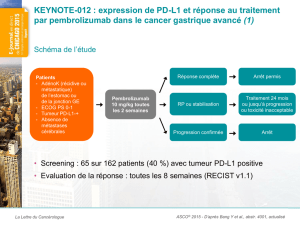
Schéma de l’étude
Patients
Cancer de l’ovaire
résistant ou en rechute
(n = 75)
•
ECOG PS 0/1
•
Pas de présélection
PD-L1
Posologie
Avélumab 10 mg/kg i.v
.
toutes les 2 semaines
jusqu’à progression
Objectifs
Objectif principal
Toxicité
Objectifs secondaires
Taux de réponse, SSP,
SG, statut PD-L1
RECIST 1.1 et irRC
Cancer de l’ovaire
ASCO®2015 -D’après Disis ML et al., abstr. 5509 actualisé

La Lettre du CancérologueLa Lettre du Cancérologue
Meilleure
réponse globale
selon RECIST 1.1
Ovaire
(n = 75)
n (%) IC95
Réponse complète (%)
0
Réponse partielle (%)
8 (10,7)
Maladie stable (%)
33 (44,0)
Progression (%)
26 (34,7)
Réponse objective, n (%)
8 (10,7) 4,7-19,9
Contrôle de la maladie, n (%)
41 (54,7)
Durée médiane de suivi : 5 mois (3-15 mois)
ASCO®2015 -D’après Disis ML et al., abstr. 5509 actualisé
Meilleure réponse globale
Essai de phase Ib de l’avélumab (anti-PD-L1)
dans le cancer de l’ovaire résistant ou en rechute

La Lettre du CancérologueLa Lettre du Cancérologue ASCO®2015 -D’après Disis ML et al., abstr. 5509 actualisé
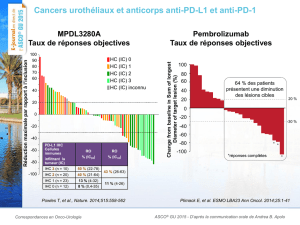
Meilleure variation des lésions cibles par rapport à l’inclusion
•Une réduction tumorale ≥ 30 % a été observée chez 11 patients (14,7 %),
incluant 2 des 2 patients avec histologie à cellules claires
–8 patients avec RP selon RECIST, 1 non confirmée
–2 patients supplémentaires avec RP selon irRC (Immune-related Response Criteria)
100
80
60
40
20
0
-20
-40
-60
-80
-100
Patients avec histologie à cellules claires
Variation de la somme des
plus grands diamètres (%)
RP (RECIST)
RP (irRC)
120
Essai de phase Ib de l’avélumab (anti-PD-L1)
dans le cancer de l’ovaire résistant ou en rechute

La Lettre du CancérologueLa Lettre du Cancérologue ASCO®2015 -D’après Varga A et al., abstr. 5510 actualisé
KEYNOTE 028 : essai multicohorte de phase Ib
du pembrolizumab (anti-PD-1)
Schéma de l’étude
Résultats de la cohorte Cancer de l’ovaire avancé
Patients
• Cancer de l’ovaire
avancé, des trompes
de Fallope
ou de carcinome
péritonéal primitif
•Échec ou inéligibilité
à un traitement
standard
•ECOG PS 0/1
• ≥ 1 lésion mesurable
•PD-L1+
RC, RP ou
maladie stable
Progression
confirméea
ou toxicité
intolérable
Evaluation de
la réponse*
Pembrolizumab
10 mg/kg i.v.
toutes les 2 sem
Traitement
pour 24 mois
ou jusqu’à
progressionaou
toxicité intolérable
Arrêt du
pembrolizumab
* Évaluation de la réponse : toutes les 8 semaines pendant les 6 premiers mois ; toutes les 12 semaines ensuite
Critères principaux : taux de réponse selon RECIST 1.1 et tolérance
Critères secondaires : SSP, SG, durée de la réponse
ales patients stables devaient restaient sous pembrolizumab jusqu’à progression, confirmée par un second scan réalisé ≥ 4 sem après. Les patients
qui avaient progressé pouvaient continuer recevoir du pembrolizumab jusqu’à 1 an, si aucun autre traitement n’était administré

La Lettre du CancérologueLa Lettre du Cancérologue ASCO®2015 -D’après Varga A et al., abstr. 5510 actualisé
KEYNOTE 028 : essai multicohorte de phase Ib
du pembrolizumab
Activité antitumorale
Résultats de la Cohorte du cancer de l’ovaire avancé
n = 26
Meilleure
réponse globale n % IC95
Taux
de réponse 3 11,5 2,4-30,2
Réponse complète 1 3,8 0,1-19,6
Réponse partielle 2 7,7 0,9-25,1
Maladie stable
6 23,1 9,0-43,6
Progression
17 65,4 44,3-82,8
Taux de contrôle
de la maladie 9 34,6 17,2-55,7
 6
6
1
/
6
100%