Communiqué de presse - MSD Belgium Authoring

Communiqué de presse
____________________________________________________________________________________
Contacts avec les
médias :
Nilsy Desaint
Policy and
Communication Manager,
MSD
nilsy.desaint@merck.com
GSM : 0473 33 4875
Les résultats présentés au congrès annuel 2015 de l’ASCO viennent s’ajouter à la
base de connaissances sur le Pembrolizumab ; une activité anti-tumorale a
maintenant été mise en évidence dans le cas de 13 types de tumeurs.
Nouvelles données présentées au congrès de l’ASCO concernant plusieurs cancers
difficiles à traiter, y compris le cancer bronchique à petites cellules, le cancer de
l’œsophage et le cancer de l’ovaire
Études registres sur le Pembrolizumab actuellement menées sur huit types de tumeurs
Bruxelles, 3 Juin 2015 – MSD, connu sous le nom de Merck aux États-Unis et au Canada, a
annoncé la première présentation des résultats de l’étude KEYNOTE-028 de phase 1b sur
l’utilisation du pembrolizumab, le traitement anti-PD-1 du laboratoire, dans plusieurs cancers
difficiles à traiter, y compris le cancer bronchique à petites cellules (CBPC), le cancer de
l’œsophage et le cancer de l’ovaire. Ces données, qui ont été présentées au 51ème congrès
annuel de l’ASCO (American Society of Clinical Oncology) à Chicago, 29 mai – 2 juin 2015,
viennent s’ajouter au programme de développement clinique immuno-oncologique d’envergure
et à croissance rapide de MSD sur le pembrolizumab.
« L’étendue et l’ampleur des données diffusées au congrès de l’ASCO renforcent le
potentiel d’activité clinique étendue que nous avons observé avec le pembrolizumab dans
plusieurs types de cancer » a déclaré le Dr Roy Baynes, premier vice président et chef de
développement clinique international des laboratoires de recherche de Merck. « Notre but est
d’aider les personnes atteintes d’un cancer et ces données ont permis d’approfondir nos
connaissances concernant les patients les plus susceptibles de retirer un bénéfice de notre
traitement anti-PD-1. »
Depuis le congrès de l’ASCO, les données présentées ont montré une activité anti-
tumorale du pembrolizumab dans 13 types de tumeur. Des études registres portant sur huit
types de tumeurs ont été planifiées ou sont en cours, en monothérapie ou en combinaison avec

- 2 -
d’autres traitements. Le pembrolizumab a été le premier traitement anti-PD-1 à être approuvé
aux États-Unis et est actuellement indiqué à une dose de 2 mg/kg administrée toute les trois
semaines pour le traitement de patients atteints d’un mélanome inopérable ou métastatique
avec progression de la maladie après un traitement par ipilimumab et, s’il est positif pour la
mutation BRAF V600, par un inhibiteur de BRAF.
L’étude KEYNOTE-028 de phase 1b
KEYNOTE-028 est une étude panier non randomisée à plusieurs bras de phase 1b
menée actuellement pour évaluer la sécurité, la tolérabilité et l’activité antitumorale de la
monothérapie par pembrolizumab (10 mg/kg toutes les deux semaines) chez plus de 450
patients atteints de 20 cancers différents. L’étude a évalué des patients avec des tumeurs
solides avancées PD-L1 positives n’ayant pas répondu au traitement actuel ou pour lesquelles
le traitement actuel est inapproprié.
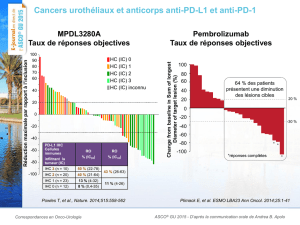
Résultats initiaux du groupe de cancer bronchique à petites cellules (Abstract #7502)
Ces résultats initiaux chez 20 patients atteints d’un CBPC précédemment traités
lourdement, présentés le samedi 30 mai par le Dr Patrick Ott, de la Dana-Farber Cancer
Institute, ont montré un taux de réponse globale (TRO) (confirmé et non confirmé) de 35 pour
cent (n=7/20) (IC à 95%, 15-59) (selon les critères RECIST v1.1). Au moment de l’analyse, six
des sept réponses étaient en cours. La durée médiane de suivi pour les patients évaluables
était de 21 semaines (plage de 2-48). Les événements indésirables étaient cohérents avec les
données de sécurité rapportées précédemment pour le pembrolizumab. Des événements
indésirables liés au traitement (survenant chez deux patients ou plus) ont été observés chez 14
patients. Les événements indésirables de grade 3-4 liés au traitement, évalués par
l’investigateur, étaient l’asthénie (n=1) et l’augmentation de la bilirubine dans le sang (n=1).
Certains patients ont ressentis des événements indésirables d’intérêt particulier, y compris une
thyroïdite autoimmune (n=1, grade 2) et une colite (n=1, grade 5). Il y a eu un décès lié au
traitement (colite).
Résultats initiaux du groupe de cancer de l’œsophage de stade avancé (Abstract #4010)
Ces résultats initiaux concernant 23 patients atteints de cancer de l’œsophage de stade
avancé précédemment traités lourdement, présentés lors d’un colloque de recherche clinique
dimanche 31 mai par le Dr Toshihiko Doi, National Cancer Center Hospital East, Kashiwa,
Japon, ont mis en évidence un TRO (confirmé et non confirmé) de 30,4 pour cent des patients
(n=7/23) (IC à 95%, 13,2-52,9) (selon les critères RECIST v1.1). Chez les patients atteints d’un

- 3 -
carcinome à cellules squameuses, le TRO était de 29,4 pour cent (n=5/17) et chez les patients
atteints d’un adénocarcinome, le TRO était de 40 pour cent (n=2/5). La durée médiane de la
réponse était de 40 semaines (0,1+ à 40), avec six des sept réponses en cours. Une réduction
de la tumeur a été obtenue chez 52,2 pour cent des patients évaluables. Les événements
indésirables étaient cohérents avec les données de sécurité rapportées précédemment pour le
pembrolizumab. Des événements indésirables liés au traitement (survenant chez deux patients
ou plus) ont été observés chez neuf patients. Tous les événements indésirables liés au
traitement évalués par l’investigateur étaient de grade 3 et incluaient une diminution de la
numération des lymphocytes (n=2), une baisse de l’appétit (n=1), des troubles hépatiques (n=1)
et une éruption cutanée (n=1). Certains patients ont ressentis des événements indésirables
d’intérêt particulier (de grade 2), y compris une hypothyroïdie (n=2) et une insuffisance
surrénale (n=1). Il n’y a eu aucun décès lié au traitement.
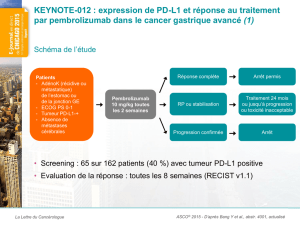
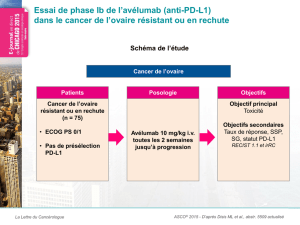
Résultats initiaux du groupe de cancer de l’ovaire de stade avancé (Abstract #5510)
Ces résultats initiaux concernant 26 patients atteints d’un cancer de l’ovaire de stade
avancé, précédemment traités lourdement, qui seront présentés lors d’un colloque de recherche
clinique lundi 1er juin par le Dr Andrea Varga, Institut Gustave Roussy, Villejuif, France, ont mis
en évidence un TRO (confirmé et non confirmé) de 11,5 pour cent des patients (n=3/26) (IC à
95%, 2,4-30,2) (selon les critères RECIST v1.1). En outre, le taux de contrôle de la maladie
(TCM) était de 34,6 pour cent (n=9/26) (IC à 95%, 17,2-55,7). Au moment de l’analyse, la durée
médiane de la réponse n’avait pas été atteinte (27,9-36,3). Une réduction de la tumeur a été
obtenue chez 23 pour cent des patients évaluables. Les événements indésirables étaient
cohérents avec les données de sécurité rapportées précédemment pour le pembrolizumab. Des
événements indésirables liés au traitement (survenant chez deux patients ou plus) ont été
observés chez 18 patients. Un événement indésirable de grade 3-4 lié au traitement a été
observé (augmentation des transaminases). Certains patients ont ressenti des événements
indésirables d’intérêt particulier, dont une hyperthyroïdie (n=2), une hypothyroïdie (n=3), une
myosite (n=1) et une pancréatite (n=1). Il n’y a pas eu de décès lié au traitement.
À propos du cancer du poumon
Le cancer du poumon, qui se développe dans le tissu pulmonaire, habituellement dans
les cellules qui tapissent les voies aériennes, est la cause principale de décès par cancer à
travers le monde. Les deux principaux types de cancer du poumon sont le cancer bronchique
non à petites cellules (CBNPC) et le cancer bronchique à petites cellules (CBPC). En 2012, on
estimait le nombre de nouveaux cas diagnostiqués de cancer du poumon à 1,8 millions à

- 4 -
travers le monde. Le CBPC correspond à environ 10-15 pour cent de tous les cas de cancer du
poumon.
À propos du cancer de l’œsophage
Le cancer de l’œsophage est un type de cancer qui naît dans la couche interne (la
muqueuse) de l’œsophage et se développe ensuite vers l’extérieur. Il existe deux principaux
types de cancer de l’œsophage : le carcinome à cellules squameuses et l’adénocarcinome. En
2012, on estimait les nouveaux cas de cancer de l’œsophage à 456 000 et le nombre de décès
liés au cancer de l’œsophage à 400 000 à travers le monde, ce qui en fait le huitième cancer le
plus courant.
À propos du cancer de l’ovaire
Le cancer de l’ovaire est un type de cancer qui se développe dans les ovaires. Il existe
trois pincipaux types de tumeurs ovariennes : les tumeurs ovariennes de cellules épithéliales,
les tumeurs ovariennes de cellules germinales et les tumeurs stromales ovariennes. En 2012,
on estimait le nombre de nouveaux cas de cancer ovarien à 239 000 et le nombre de décès liés
au cancer de l’ovaire à 152 000 à travers le monde.
À propos de PD-L1 et de l’expression de PD-L1
PD-L1, pour « programmed death-ligand 1 » (ligand de mort programmée 1), est une
protéine exprimée sur de nombreux types de cellules, y compris certaines cellules cancéreuses.
Dans des conditions normales, l’interaction de PD-L1 avec une autre protéine, un récepteur de
mort programmée appelé PD-1 (pour programmed death receptor-1), sert de checkpoint
important pour le système immunitaire en le gardant en équilibre et en empêchant l’organisme
d’attaquer ses propres cellules en cas d’inflammation ou d’infection. Lorsques les tumeurs
expriment PD-L1, cependant, elles peuvent échapper à la détection et à la destruction par les
cellules T cytotoxiques – un type de cellules immunitaires qui tuent les cellules cancéreuses –
ce qui permet à la tumeur de survivre et de se développer. L’expression de PD-L1 par la tumeur
a été observée à des degrés différents dans de nombreux types de tumeurs, y compris les
cancers du sein, du poumon et de la vessie. Les niveaux élevés d’expression de PD-L1 sont en
cours d’étude pour voir s’ils pourraient être utilisés pour aider à identifier les patients les plus
susceptibles de répondre à certains types d’immunothérapie.
À propos du pembrolizumab
Le pembrolizumab est un anticorps monoclonal humanisé qui bloque l’interaction entre

- 5 -
PD-1 et ses ligands, PD-L1 et PD-L2. En se liant au récepteur de PD-1 et en bloquant
l’interaction avec les ligands du récepteur, le pembrolizumab lève l’inhibition de la réponse
immunitaire médiée par la voie du PD-1, et notamment la réponse immunitaire antitumorale.
MSD mène un programme de développement clinique d’envergure et à croissance
rapide pour le KEYTRUDA. En effet, ce programme comprend plus de 100 essais cliniques,
concernant plus de 30 types de tumeurs et plus de 16 000 patients, en monothérapie et en
association avec d’autres thérapies.
Notre intérêt pour le cancer
Notre objectif est de traduire les percées scientifiques en médicaments oncologiques
innovants pour aider les personnes atteintes de cancer dans le monde entier. Chez MSD
Oncologie, aider à lutter contre le cancer est une passion et nous nous engageons à favoriser
l’accès à nos médicaments contre le cancer. Notre priorité est de poursuivre la recherche en
immuno-oncologie et nous mettons tout en oeuvre pour accélérer le processus, du laboratoire à
la clinique, pour offrir un nouvel espoir aux personnes atteintes d’un cancer.
À propos de MSD
MSD est un leader mondial dans le domaine de la santé qui propose des médicaments,
des vaccins, des thérapies biologiques ainsi que des produits vétérinaires innovants afin de
promouvoir la santé et le bien-être des hommes et des animaux. Nous collaborons avec nos
clients dans plus de 140 pays afin de donner aux patients l’accès aux meilleures solutions de
santé.
Notre société est dénommée Merck aux États-Unis et au Canada et MSD dans les autres pays.
En Belgique et au Grand-Duché du Luxembourg, MSD fait partie des acteurs les plus
importants de l’innovation médicale. Nous y déployons une palette très large d’activités : la
recherche, la production et la commercialisation.
Pour plus d’informations, visitez www.msd-belgium.be ou www.msd.com.
Déclarations prospectives
Ce communiqué de presse contient des « déclarations prospectives » (forward looking
statements) au sens des dispositions libératoires de la loi américaine de 1995 intitulée « Private
Securities Litigation Reform Act ». Ces déclarations sont fondées sur les convictions et les
prévisions actuelles de la direction de MSD et sont exposées à de nombreux risques et
 6
6
1
/
6
100%