Principes de la chirurgie du cancer de l`estomac

Principes de la chirurgie
du
cancer de l’estomac
Indications
Techniques chirurgicales
Résultats
B. Meunier

Introduction (1)
9000 nouveaux cas / an en France
5 ° rang des cancers en France
70 ans masculin
ADK estomac en baisse depuis 20 ans
ADK cardia (légère )
Chirurgie seul traitement curatif
Chirurgie curative : R0

Introduction (2)
Adénocarcinome de l’estomac
Centre 2cm en dessous jonction oesogastrique
Exclusion:
Tumeurs du cardia
Tumeur stromale
Lymphome
Tumeur endocrine

Indications
Résécables : stades T1, T2 et T3
Résécables :
Certains Stades T4: côlon transverse, queue du pancréas, rate,
lobe gauche du foie
Non résécables : StadesT4 avec extension rétro-péritonéale
(aorte, pédicule rénal ...), ou vers la racine du mésentère, un
envahissement du corps et de la tête du pancréas vont faire
considérer la tumeur comme non résécable
Intérêt cœlioscopie diagnostic au moindre doute +++ grosse
tumeur, résécabilité douteuse, suspîcion de M+ foie ou carcinose;
Niveau de grade C,

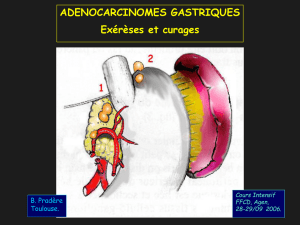
Type de chirurgie
Le type de résection gastrique
du type histologique
du siège du cancer
de son extension locale
Mais le curage gg est fonction
du siège du cancer
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
1
/
50
100%