Données sur le pembrolizumab de Merck, tirées de la plus vaste

Communiqué de presse
__________________________________________________________________________________
Résumé nº LBA9000
Relations avec les médias:
Marie-Christine Garon Dominique Quirion
Merck Le Cabinet de relations publiques NATIONAL
514 409-0031 514 843-2302
Relations avec les investisseurs :
Justin Holko : (+1 908 423-5088 ou [email protected])
Carol Ferguson : (+1 908 423-4465 ou [email protected]om)
Données sur le pembrolizumab de Merck, tirées de la plus vaste étude
menée à ce jour sur un anticorps anti-PD-1 expérimental dans le traitement
de formes avancées de mélanomes, présentées au congrès de l’ASCO 2014
Le pembrolizumab administré en monothérapie a montré des taux de survie globaux estimés de
69 % à un an chez 411 patients présentant un mélanome avancé, à divers stades de la
maladie, et ayant déjà reçu un traitement.
Des réponses durables et un profil de tolérabilité uniforme ont été observés pour les différentes
doses, notamment chez les patients qui avaient déjà reçu de l’ipilimumab et chez ceux qui n’en
avaient pas reçu.
Études de phase III en cours ou prévues pour différents schémas thérapeutiques, notamment
un traitement adjuvant
CHICAGO, le 2juin2014 – Merck (NYSE: MRK) a annoncé aujourd’hui l’obtention de
nouvelles données tirées d’une vaste étude de phaseIb (KEYNOTE-001) qu’elle mène
actuellement pour évaluer le pembrolizumab, un anticorps anti-PD-1 expérimental, comme
agent unique (monothérapie) chez 411patients présentant des formes avancées de
mélanomes. À la suite du traitement par le pembrolizumab, le taux de survie globale (SG)
estimé à un an était de 69% pour tous les patients de l’étude, notamment chez 74% des
patients qui n’avaient jamais reçu de traitement par l’ipilimumab (traitement standard actuel) et
chez 65% des patients qui présentaient une maladie évolutive pendant ou après un traitement
par l’ipilimumab. À 18mois, la SG estimée était de 62%. La SG médiane n’a pas été atteinte,
certains patients ayant reçu le traitement pendant plus de deux ans.
Ces nouvelles données seront présentées aujourd’hui lors d’un exposé oral du
DrAntoniRibas, professeur d’hémato-oncologie et de chirurgie, et directeur du Tumor

- 2 -
Immunology Program au Jonsson Comprehensive Cancer Center de l’Université de Californie,
à LosAngeles. L’exposé aura lieu dans le cadre du 50econgrès annuel de l’American Society of
Clinical Oncology (ASCO 2014) à Chicago (résumé nºLBA9000; 15 h heure du Centre;
emplacement E, Arie Crown Theater).
« Les données présentées aujourd’hui viennent appuyer davantage l’activité anti-
tumorale durable stimulée par le pembrolizumab comme agent unique chez les patients
présentant un mélanome malin, affirme le Dr Roger M. Perlmutter, président des Laboratoires
de recherche de Merck. Bien que l’on attende la confirmation de ces données par des études
cliniques contrôlées, les taux de survie observés avec le traitement par le pembrolizumab,
notamment chez les patients présentant une forme avancée de la maladie et chez qui les autres
traitements ont échoué, appuient le recours à la manipulation du système immunitaire dans le
traitement du cancer. »
Nouvelles données sur le pembrolizumab dans le traitement des formes avancées de
mélanomes
Les données des 411patients atteints de formes avancées de mélanomes admis dans
plusieurs cohortes de l’étude KEYNOTE-001, la plus vaste étude de phaseIb à ce jour sur un
anticorps anti-PD-1, seront présentées dans le cadre du programme destiné à la presse de
l’ASCO 2014. L’étude KEYNOTE-001 regroupait sept cohortes de patients atteints de formes
avancées de mélanomes à divers stades de la maladie et ayant reçu différents schémas
thérapeutiques auparavant. Au départ, 56 % des patients étaient au stade le plus avancé de la
maladie (M1c) (n = 232) et 77 % des patients avaient déjà reçu au moins un traitement général
(n = 316). Les données intérimaires d’une seule cohorte de 135 patients de l’étude KEYNOTE-
001 ont d’abord été présentées au congrès de l’ASCO 2013 et publiées simultanément dans le
New England Journal of Medicine. Plus récemment, un rapport des résultats à jour de cette
cohorte a été présenté lors du 10e congrès international de la Society for Melanoma Research
(novembre 2013).

- 3 -
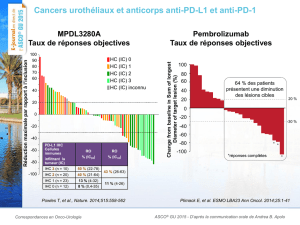
Taux de réponse objective (TRO) d’après les critères de réponse liée au système
immunitaire (irRC) et les critères RECIST chez 411 patients présentant des formes
avancées de mélanomes
Dose irRC – Évaluation
effectuée par le chercheur
RECIST 1.1 – Examen
centralisé†
N 1TRO, %
(IC à 95 %)
N1TRO, %
(IC à 95 %)
Patients non traités par
l’ipilimumab
190 43 (36 - 51) 168 40 (32 - 48)
Patients traités par
l’ipilimumab
221 31 (25 - 37) 197 28 (22 - 35)
Total 411 37 (32 - 41) 365 34 (29 - 39)
Date limite de l’analyse : octobre 2013; date limite de l’analyse de la SG : mai 2014
1Taux de réponse objective = réponse complète (RC) et réponse partielle (RP) confirmées
† Comprend les patients traités dont l’évolution de la maladie était mesurable au départ d’après
l’examen centralisé en fonction des critères RECIST 1.1.
Au moment de l’analyse, 88 % (n = 115/130) des réponses signalées chez les patients
évaluables persistaient et la durée médiane de la réponse, selon les critères RECIST, n’avait
pas été atteinte (n = 115/130) (fourchette de plus de 6 semaines à plus de 76 semaines). La
survie sans progression (SSP) médiane, selon les critères RECIST, était de 5,5 mois dans
l’ensemble (IC à 95 % : 3,8-6,2), de 5,6 mois chez les patients n’ayant jamais été traités par
l’ipilimumab (IC à 95 % : 3,7-11) et de 5,4 mois chez les patients qui présentaient une maladie
évolutive pendant ou après le traitement par l’ipilimumab (IC à 95 % : 3,2-5,6). Une activité anti-
tumorale a été observée pour toutes les doses étudiées, sans égard au type et au nombre de
traitements antérieurs (y compris un traitement antérieur par l’ipilimumab), à l’indice fonctionnel,
au taux de lacticodéshydrogénase (LDH), au statut de mutation du gène BRAF, à la taille de la
tumeur au départ et à la région anatomique des métastases. Une analyse de sous-groupes de
patients indique que la présence d’une masse tumorale faible au départ est un facteur prédictif
important de la réponse au pembrolizumab.
Chez les patients dont l’évolution de la maladie était mesurable au départ et qui avaient
subi au moins un examen de tomodensitométrie, 72 % (n = 227/317) ont présenté une
réduction de la taille de la tumeur, dont 39 % (n = 123/317) ont obtenu une réduction tumorale
de plus de 50 % selon les critères RECIST. D’après les critères de réponse liée au système
immunitaire (irRC) (examen centralisé), 64 % (n = 204/319) des patients ont présenté une
réduction de la taille de la tumeur, dont 31 % (n = 100/319) ont obtenu une réduction tumorale
de plus de 80 %.

- 4 -
L’incidence des effets indésirables signalés était conforme aux données déjà obtenues
sur le pembrolizumab. Les effets indésirables liés au traitement et évalués par le chercheur les
plus fréquents étaient de grade 1 ou 2 et comprenaient la fatigue (36 %), le prurit (24 %), les
éruptions cutanées (20 %), la diarrhée (16 %), l’arthralgie (16 %), les nausées (12 %), le vitiligo
(11 %), l’asthénie (9 %) et la toux (9 %). Les effets indésirables liés au système immunitaire les
plus fréquents comprenaient l’hypothyroïdie (8 %) et l’hyperthyroïdie (1 %). Douze (3 %) cas de
pneumonite liée au traitement ont été signalés, dont un de grade 3 ou 4. L’effet indésirable de
grade 3 ou 4 lié au traitement qui était le plus souvent signalé était la fatigue (2 %). Dans
l’ensemble, 17 patients (4 %) ont abandonné le traitement en raison d’effets indésirables liés au
traitement selon l’évaluation du chercheur. Aucun décès lié au traitement n’a été signalé.
Posologie et autres données sur les formes avancées de mélanomes présentées à
l’ASCO 2014
La posologie du pembrolizumab a été analysée chez tous les patients évaluables
atteints d’un mélanome de stade avancé. En effet, deux doses de pembrolizumab qui ont été
comparées feront l’objet d’un exposé oral le mardi 3 juin à l’ASCO (résumé nº 3000; 9 h 45
heure du Centre; emplacement S100a). D’après ces données d’étude à répartition aléatoire,
visant à comparer des doses de 2 mg/kg et de 10 mg/kg administrées toutes les trois semaines,
et les données d’étude à répartition aléatoire d’une autre cohorte comparant une dose de
10 mg/kg administrée toutes les deux ou trois semaines, lesquelles devraient être présentées
lors d’un prochain congrès, la dose recommandée de pembrolizumab proposée pour le
traitement des formes avancées de mélanomes est de 2 mg/kg une fois toutes les trois
semaines.
Les données sur l’évaluation du pembrolizumab dans le traitement des formes avancées
de mélanomes font l’objet d’autres exposés oraux ainsi que d’une présentation par affiche à
l’ASCO 2014. Pour en savoir plus au sujet des données sur les formes avancées de
mélanomes qui seront présentées, voir le calendrier (iPlanner) de l’ASCO :
https://iplanner.asco.org/am2014.
À propos de l’étude KEYNOTE
L’étude de phase Ib (KEYNOTE-001) est une étude multicentrique en cours, ouverte et
à un seul volet, visant à évaluer le pembrolizumab en monothérapie chez plus de 1 000 patients
atteints de divers types de cancer de stade avancé (carcinomes métastatiques), principalement
le cancer du poumon et le mélanome. Trois schémas posologiques du pembrolizumab ont été
évalués, notamment l’administration de 10 mg/kg toutes les deux semaines, de 10 mg/kg toutes

- 5 -
les trois semaines et de 2 mg/kg toutes les trois semaines. Les paramètres d’évaluation
principaux de l’étude comprennent le taux de réponse globale et l’innocuité. Les paramètres
d’évaluation secondaires comprennent la survie sans évolution de la maladie, le taux de survie
globale et la durée de la réponse. Chez les patients atteints d’une forme avancée de mélanome,
la réponse de la tumeur a été évaluée toutes les 12 semaines selon les critères de réponse liée
au système immunitaire (irRC) évalués par le chercheur et par une revue indépendante,
centrale et sous insu, faite par radiographie selon les critères RECIST 1.1 (Response
Evaluation Criteria in Solid Tumors).
À propos du pembrolizumab chez les patients atteints d’une forme avancée de
mélanome
Le pembrolizumab est un anticorps anti-PD-1 monoclonal, humanisé, sélectif et
expérimental, conçu pour bloquer l’interaction de la PD-1 sur les lymphocytes T par l’entremise
de ses ligands, le PD-L1 et le PD-L2, pour réactiver l’immunité anti-tumorale. Le pembrolizumab
inhibe les deux ligands bloqueurs de la voie du récepteur PD-1.
Le pembrolizumab est évalué relativement à plus de 30 types de cancers, en
monothérapie et en association. Merck a un vaste programme de développement visant à
évaluer le pembrolizumab dans le traitement des formes avancées de mélanomes à divers
stades de la maladie, pour différents schémas thérapeutiques et en association avec d’autres
agents anticancéreux. L’entreprise compte actuellement deux études de phase III en cours
(KEYNOTE-002, 006) sur les formes avancées de mélanomes ainsi qu’une étude planifiée sur
un traitement adjuvant pour la même indication.
Une demande d’homologation (Biologics License Application ou BLA) relativement au
pembrolizumab fait actuellement l’objet d’un examen prioritaire par la Food and Drug
Administration (FDA) des États-Unis pour l’indication proposée, c’est-à-dire dans le traitement
des patients qui présentent des formes avancées de mélanomes et qui ont déjà été traités par
l’ipilimumab; la date butoir en vertu du Prescription Drug User Fee Act (PDUFA) est le
28 octobre 2014. Aux États-Unis, la FDA a accordé au pembrolizumab la désignation de
Breakthrough Therapy Designation (percée thérapeutique) pour le traitement des formes
avancées de mélanomes. S’il est homologué par la FDA, le pembrolizumab pourrait être le
premier modulateur de point de contrôle (checkpoint) immunitaire PD-1 approuvé dans sa
catégorie. L’entreprise prévoit déposer une demande d’autorisation de mise en marché en
Europe relativement au pembrolizumab pour le traitement des formes avancées de mélanomes
d’ici la fin de 2014.
 6
6
 7
7
1
/
7
100%