L
e congrès de l'ASCO 2004 a été marqué essentielle-
ment dans le domaine des tumeurs digestives par les
présentations d’études de phase III de chimiothérapie
adjuvante dans le cancer du côlon et de chimiothérapie pallia-
tive dans le cancer du pancréas avancé. Pour la première fois,
une étude avec un large effectif a démontré l’intérêt d’une
chimiothérapie par 5-FU et acide folinique (AF) dans les can-
cers du côlon de stade II. Le schéma IFL pour les stades III
(irinotécan, 5-FU bolus hebdomadaire et AF) n’améliore pas la
survie sans rechute et la survie globale par rapport au schéma
de la Mayo Clinic. L’abandon définitif du schéma de la Mayo
Clinic a été entériné par deux études qui l’ont comparé en situa-
tion adjuvante aux fluoropyrimidines orales (capécitabine
et UFT). Dans le cancer du pancréas avancé, quatre études de
p h a s e III ont été présentées, le standard restant la gemcitabine.
Le GEMOX (gemcitabine + oxaliplatine) est le seul challenger
de la gemcitabine à avoir obtenu un meilleur taux de réponse,
une meilleure survie sans progression (PFS) et une amélioration
du bénéfice clinique, mais sans amélioration statistiquement
significative de la survie globale. Parmi les 775 abstracts sou-
mis dans le domaine digestif, 200 ont été présentés sous forme
de poster, 36 sous forme de poster- discussion et 20 en commu-
nication orale.
PRÉVENTION DU CANCER COLORECTAL
Les inhibiteurs de l’HMG-CoA réductase (3-hydroxy-2-méthyl-
glutaryl coenzyme A) sont des agents hypolipémiants, qui,
dans une étude randomisée chez des patients avec un infarctus
du myocarde, diminuaient le risque de développer un cancer
c o l o r e c t a l .
Une étude cas témoin a été présentée en séance plénière ( a b s-
t r a c t 1 ) . Mille six cent huit cas de cancer du côlon ont été
diagnostiqués en Israël entre 1998 et 2002. Une population de
17 3 4 cas contrôle y a été appariée. La prise d’inhibiteur de
l’HMG-CoA réductase était associée à un effet protecteur avec
un odds-ratio de 0,46 (IC
9 5
: 0,35-0,60). Cette association per-
sistait après ajustement avec les autres facteurs de risque connus
(âge, hypercholestérolémie, race, aspirine, AINS et faible péné-
trance de l’allèle de prédisposition APC I1307K). La prise d’inhi-
biteur de l’HMG-CoA réductase est associée à une diminution
de 51 % du risque de cancer colorectal. Des études prospectives
sont nécessaires pour confirmer cette donnée.
CANCERS COLORECTAUX : TRAITEMENT ADJUVANT
L’étude QUASAR a comparé du 5-FU +AF (schéma Roswell
Park : 5-FU bolus +AF hebdomadaire pendant 30 semaines ou
schéma de la Mayo Clinic pendant 24 semaines) versus obser-
vation (abstract 3501). Dans cette étude pragmatique, les patients
pouvaient être inclus si leur médecin considérait que l’indication
d’une chimiothérapie adjuvante était incertaine. Trois mille deux
cent trente-neuf patients ont été randomisés, 1 617 dans le bras
observation et 1 622 dans le bras chimiothérapie. Les caractéris-
tiques des patients étaient parfaitement réparties entre les
deux bras avec 92 % de stades I et II, 8 % de stade III, 71 % de
cancers du côlon et 29 % de cancers du rectum ou des deux, un
âge médian de 63 ans, 51 % de schéma de la Mayo Clinic, 6 %
de radiothérapie préopératoire et 8 % de radiothérapie postopé-
ratoire. Le suivi médian était de 4,6 ans. Le nombre de décès pen-
dant le traitement était similaire dans les deux bras : 4 et 4,2 %.
La survie sans récidive (RFS) à 5 ans pour tous les patients inclus
était de 77,8 % dans le bras chimiothérapie versus 73,8 % dans
le bras observation (p = 0,001 ; HR à 0,78 ; IC
95
: 0,67-0,91). La
survie globale à 5 ans (OS) était de 80,3 % dans le bras chimio-
thérapie versus 77,4 % dans le bras observation (p = 0,02 ; HR à
0,83 ; IC
95
: 0,71-0,97). Tous les sous-groupes tiraient bénéfice
du traitement. Concernant les stades II, 224 décès sont survenus
dans le bras chimiothérapie et 262 dans le bras observation
(p = 0,04), ce qui correspond à un gain de survie globale de 3 %.
Les auteurs concluent à un bénéfice faible, mais significatif en
termes de survie globale (3 %) pour les patients avec un stade II
traités par chimiothérapie (5-FU + AF ± lévamisole) (figure 1).
Cancers digestifs
T. André*
107
La Lettre du Cancérologue - Volume XIII - n
o
3 - mai-juin 2004
*Service d’oncologie médicale, hôpital Tenon, Paris.
Figure 1.
Courbe de survie globale des stades B (stade II) de l’étude
QUASAR.
C
A N C E R S D I G E S T I F S

L’étude C06 du NSABP (abstract 3508) a comparé un schéma
de 5-FU et AF (schéma Roswell Park) à de l’UFT + A F
(24 semaines de traitement dans les deux bras). Les caractéris-
tiques des patients étaient parfaitement réparties dans les
d e u x bras, avec respectivement 46 % et 47 % de stades II et 54 %
et 53 % de stades III. Le profil de tolérance était similaire, avec
37 % de toxicité de grade 3-4 et 1 % de décès (durant le traite-
ment) dans les deux bras. Mille deux cent soixante-quatre patients
ont été randomisés, et le suivi médian était de 62 mois. Les résul-
tats des deux traitements étaient identiques en termes de survie
globale (OS) (p = 0,88) et de survie sans maladie (DFS) (p = 0 , 7 9 ) .
Les auteurs concluaient à l’équivalence de ces deux schémas en
termes de toxicité, de survie globale et de survie sans maladie.
L’étude X-ACT (abstract 3509) a comparé le schéma Mayo Cli-
nic (FUFOL mensuel pendant 24 semaines) à la capécitabine
( 1 2 5 0 m g / m
2
x 2/j, 14 jours sur 21 pendant 24 s e m a i n e s ) .
L’objectif principal de l’étude était de montrer une équivalence
de 3 ans entre les deux bras (puissance de 80 % pour montrer au
moins une équivalence si la limite supérieure de l’intervalle de
confiance à 95 % pour le HR était inférieure à 1,25). Entre 1998
et 2001, 1 987 patients ont été inclus. Le profil de tolérance était
meilleur pour le bras capécitabine avec moins de neutropénies,
de mucites et de diarrhées, mais plus de syndromes mains-pieds
(Ann Oncol 2003;14:1735-43). Les patients inclus étaient tous atteints
de tumeur de stade III. Les caractéristiques des patients étaient les
s u i v a n t e s : 14 % de T4 et 30 % de N2 dans les deux bras, respecti-
v e m e n t 17 % et 20 % des tumeurs étaient peu ou pas indifféren-
ciées (capécitabine versus Mayo Clinic), et l’ACE était supérieur
à la normale chez 20 % des patients dans le bras capécitabine ver-
sus 16 % dans le bras Mayo Clinic. La DFS à 3 ans était de
64,2 % dans le bras capécitabine et de 60,6 % dans le bras Mayo
Clinic (p = 0,0528 ; HR à 0,87 ; IC
95
: 0,75-1). La RFS à 3 ans
était de 65,5 % dans le bras capécitabine et de 61,9 % dans le bras
Mayo Clinic (p = 0,0407 ; HR à 0,86 ; IC
95
: 0,74-0,99). L’OS à
3ans était de 81,3 % dans le bras capécitabine et de 77,6 % dans
le bras Mayo Clinic (p =0,0706). Dans l’analyse multivariée, les
facteurs pronostiques étaient la capécitabine (p =0,01), le sexe
féminin (p = 0,0008), le statut ganglionnaire N2 (< 0,001) et
l’ACE supérieur à la normale (< 0,001). Dans le bras capécita-
bine, 42 % des patients ont eu une diminution de dose et 57 %
ont été concernés par une réduction de dose ou un report ou une
interruption de traitement. L’objectif principal de cette étude a
été atteint. La capécitabine s’est montrée comparable au schéma
Mayo Clinic en termes de survie globale à 3 ans, associée à une
moindre toxicité, avec une tendance à l’amélioration de la DFS
et de l’OS, en faveur de la capécitabine. La conclusion des auteurs
est que la capécitabine doit remplacer le schéma de la Mayo
Clinic dans les cancers du côlon de stade III (figure 2).
L’étude de l’intergroupe CALGB C89803 (abstract 3500) com-
parait l'IFL (FU bolus +AF hebdomadaire +irinotécan) à une
association de 5-FU et d'AF selon le schéma de la Mayo Clinic.
Les patients inclus ont tous été opérés d’une tumeur de stade III.
Avec un suivi médian de 2,6 ans, le schéma IFL n’a pas montré
d’amélioration par rapport au bras 5-FU/AF en termes d’OS
(p = 0,81) ou de DFS (p =0,84). Le nombre de décès toxiques a
été plus élevé dans le bras IFL que dans le bras FUFOL (18 ver-
sus 6 ; p =0,80). Le nombre de décès pendant le traitement a été
de 2,8 % dans le bras IFL et de 1 % dans le bras Mayo Clinic
(p = 0,008). Le schéma IFL est plus toxique que le FUFOL de
la Mayo Clinic, sans diminution du taux de rechute, et ne doit
pas être utilisé dans le traitement des cancers du côlon de stade I I I .
Une analyse des patients avec un stade II, inclus dans l’étude
MOSAIC (LV5FU2 versus FOLFOX4), a été présentée avec des
données actualisées (abstract 3619).Le risque de rechute pour
les stades II et III était respectivement de 20 et 24 %. Dans l’étude
MOSAIC, si on considère les stades II à haut risque (T4, ou
occlusion, ou perforation, ou tumeur peu différenciée, ou inva-
sion veineuse, ou nombre de ganglions inférieur à dix), la dimi-
nution du risque de rechute est alors de 28 %. L’étude MOSAIC
ne permet pas de conclure à l’intérêt d’une chimiothérapie pour
les stades II. Cependant, si la décision de faire une chimiothérapie
est prise en prenant en compte l’évaluation individuelle de leur
risque potentiel de rechute, le schéma FOLFOX4 peut être consi-
déré comme une option thérapeutique pour les stades II à risque.
Une analyse avec des données individuelles de quinze é t u d e s
randomisées de traitement adjuvant dans le cancer du côlon ( a b s-
tract 3502), a montré qu’il existe une étroite corrélation entre la
DFS à 3 ans et l’OS à 5 ans. Cette étude regroupait des données
individuelles de 17 3 6 7 patients. Les caractéristiques des patients
étaient 1 % de stade I, 34 % de stade II et 65 % de stade III. Les
taux de rechute de 1 à 5 ans étaient de 11, 13, 7, 4 et 3 %, et le
délai moyen entre la rechute et le décès était de 1,1 an ; 74 % des
rechutes sont survenues dans les trois premières années ; 95 %
des patients sans rechute de leur maladie à 3 ans étaient en vie à
5 ans ; 86 % des patients ayant rechuté à 3 ans étaient morts à
5ans. Sur les vingt-deux études analysées, dix-neuf avaient les
mêmes conclusions concernant DFS et OS (14 sans différence,
5 avec une différence significative). Seules trois études présen-
taient des résultats discordants (différence significative pour DFS,
mais pas pour OS). Ces trois études avaient un p 0,025. Cette
analyse montre une étroite corrélation entre la DFS à 3 ans et
l’OS à 5 ans, avec un petit facteur d’atténuation. La DFS à 3 ans
permet de prédire la survie à 5 ans ; elle est un objectif principal
approprié pour les essais évaluant le traitement adjuvant des
108
La Lettre du Cancérologue - Volume XIII - n
o
3 - mai-juin 2004
C
A N C E R S D I G E S T I F S
Figure 2.
Courbe de survie sans maladie (DFS) de l’étude X-ACT.

cancers du côlon par une chimiothérapie à base de 5-FU. L’adop-
tion de la DFS comme critère principal des essais thérapeutiques
évaluant des traitements en situation adjuvante dans le cancer du
côlon devrait permettre un accès plus rapide aux thérapeutiques
prometteuses.
L’étude anglaise déjà publiée avec des résultats à 3 ans (Br J Can-
cer 2003;88:1959-1965) a été présentée avec des résultats actua-
lisés à 5 ans (abstract 3523). Dans cette étude, 801 patients ont
été randomisés entre 6 mois de FUFOL de la Mayo Clinic ver-
sus perfusion continue de 5-FU à la posologie de 300 mg/m
2
/j
pendant 12 semaines. Ont été inclus dans cette étude les patients
avec cancers du côlon (60 %) ou du rectum (40 %), de stade II
(45 %) ou III (55 %). La perfusion continue de 5-FU pendant
3mois versus 6 mois de Mayo Clinic était associée avec une ten-
dance à une meilleure RFS à 5 ans (73,3 % versus 66,7 % ;
p = 0,10) et à une meilleure survie globale (OS) (75,7 % versus
7 1 , 5 % ; p = 0,0833), et cela avec une toxicité moindre. Les
auteurs concluaient à une probabilité extrêmement faible
( p < 0,005) que 12 semaines de 5-FU en perfusion continue soient
inférieures à 6 mois de 5-FU/AF selon le schéma de la Mayo
Clinic. Ils concluaient également à la nécessité d’explorer des
durées de chimiothérapie inférieures à 6 mois dans le traitement
adjuvant du cancer du côlon. Une analyse du sous-groupe a été
effectuée dans cette étude concernant les cancers du rectum. Les
résultats étaient une amélioration de la RFS pour le bras 5-FU
continu (p =0,0246) avec une tendance à l’amélioration de l’OS
( p = 0,070). Une analyse de qualité de vie concernant cette même
étude a fait l’objet d’un autre poster (abstract 3625).Les conclu-
sions des auteurs concernant cette présentation étaient que la per-
fusion continue de 5-FU pendant 3 mois est associée à une
meilleure qualité de vie.
Une étude du CALGB a montré l’intérêt du ganglion sentinelle
dans le cancer du côlon (abstract 3506). La conclusion des auteurs
était que la localisation du ganglion sentinelle ne modifie pas la
nécessité d’élargir la lymphadénectomie chez des patients ayant
des cancers du côlon résécables. L’identification du ganglion
sentinelle par injection de bleu d’isofulfan avec des techniques
classiques d’histopathologie ne permet pas d’augmenter l’inci-
dence de l’envahissement ganglionnaire.
Les résultats de l’étude EORTC 40911-FFCD 9204 ont été pré-
sentés. Il s’agissait d’une étude de phase III chez de patients
ayant des cancers du côlon de stades II et III (abstract 3620).
Mille huit cent cinquante-sept patients ont été randomisés pen-
dant la chirurgie et 1 501 avaient les critères d’éligibilité (stade I I
ou III). Cet essai posait deux questions :
La question d’une chimiothérapie régionale intrapéritonéale ou
intraportale versus pas de chimiothérapie intrapéritonéale ou
intraportale.
Une deuxième question qui comparait une chimiothérapie
systémique par 5-FU et AF selon le schéma de la Mayo Clinic à
une association de 5-FU et de lévamisole.
Il n’existait aucune différence entre les quatre bras, et la conclu-
sion des auteurs était que la combinaison de chimiothérapie
régionale et systémique n’améliore pas l’efficacité de la chimio-
thérapie systémique.
CANCER DU RECTUM ADJUVANT
Une étude japonaise de chimiothérapie adjuvante des cancers du
rectum de stade III par l’UFT (uracil et tégafur) a été présentée
(abstract 3524). Deux cent soixante-quatorze patients ont été
randomisés entre UFT + AF pendant un an versus chirurgie seule.
La RFS à 3 ans était de 78 % dans le bras UFT et de 60 % dans
le bras chirurgie seule (p = 0,0014). Concernant l’OS à 3 ans, elle
était de 91 % pour l’UFT et de 81 % pour la chirurgie seule
(p = 0,0048).
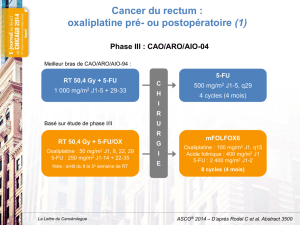
Deux études de phase III ont comparé une radiothérapie préopé-
ratoire à une radiochimiothérapie (RT-CT) préopératoire (45 Gy
versus 45 Gy+ à la première et à la cinquième semaines, avec chi-
miothérapie par 5-FU 350 m g / m
2
et AF pendant 5 jours). Les
résultats préliminaires de ces deux études montraient une aug-
mentation du taux de réponse complète histologique dans le bras
RT-CT (abstracts 3504 et 3626). Ces résultats sont en faveur de
l’association RT-CT (tableau I).
M.S. Roth (abstract 3505) a présenté les résultats de l’étude R03
du NSABP comparant une RT-CT pré- versus postopératoire. La
RT-CT préopératoire versus la RT-CT postopératoire améliorait
de façon non significative la RFS (p =0,08) et l’OS (p = 0,14).
Le taux de réponse complète histologique était corrélé de façon
statistiquement significative avec une augmentation de la RFS et
de l’OS (p < 0,05).
Cinq études de phase II d’association RT-CT avec capécita-
bine ± oxaliplatine ont été présentées en poster (abstracts 3538,
3552, 3559, 3575 et 3607). Les résultats préliminaires de ces
quatre études sont encourageants. L’étude du GERCOR a mon-
tré la faisabilité de l’association 45 Gy en 5 semaines avec de la
capécitabine à la dose de 825 mg/m
2
x2/j durant toute la durée
de la radiothérapie (abstract 3538). La tolérance de cette asso-
ciation était bonne, avec l’absence de grade 3-4 hématologique
et 3 % de diarrhée grade 3-4. Sur les 51 patients inclus, 50 ont
pu avoir l’exérèse de leur tumeur avec un taux de réponse com-
plète histologique de 24 % ; 29 patients ont eu une chirurgie
conservatrice. Sur ces 29 patients, 3 ont pu avoir une chirurgie
conservatrice, alors qu’une amputation était initialement prévue.
Cette association radiochimiothérapie simple, qui ne nécessite pas
la pose d’un site implantable, est donc bien tolérée, avec un taux
109
La Lettre du Cancérologue - Volume XIII - n
o
3 - mai-juin 2004
C
A N C E R S D I G E S T I F S
J.F. Bosset T. Conroy
(abstract 3504) (abstract 3626)
Nombre de patients 1 011 762
Réponse complète histologique (pRC)
– RT préopératoire (45 Gy) 5,3 % 3 %
– RTCT préopératoire 14 % 10 %
p < 0,001 p = 0,00001
Conservation sphinctérienne
– RT préopératoire 52,4 % 51 %
– RT-CT préopératoire 55,6 % 51 %
p = 0,05
Toxicité de grade 2-4 et 3-4
– RT préopératoire 37,7 % 2 %
– RT-CT préopératoire 54,3 % 14 %
p < 0,005 p = 0,00001
Tableau I.

de réponse complète histologique comparable à celui obtenu avec
une association de 45 Gy avec du 5-FU en perfusion continue et
supérieur à la radiothérapie seule. Des études de phase III sont
nécessaires (tableau II).
Une étude de phase II a testé l’association oxaliplatine et 5-FU
en perfusion continue durant une radiothérapie (50,4 Gy) chez
des patients ayant un cancer du rectum avancé (43 patients ayant
un stade T3 et 10 un stade T4). Le taux de réponse complète his-
tologique était de 22,7 %, et 36 % des patients qui avaient une
tumeur à moins de 5 cm de la marge anale ont pu avoir une
conservation sphinctérienne. La tolérance de l’association a été
acceptable, avec 7 % de diarrhée de grade 3 (abstract 3607).
Les résultats de tolérance de l’étude 98 de l’AERO, devenue un essai
intergroupe, ont été présentés en poster par P. Piedbois (abstract
3549). Cette étude randomisée pour des cancers du rectum de
s t a d e II ou III après chirurgie (radiothérapie néoadjuvante recom-
mandée) comparait une chimiothérapie à base de 5-FU et AF
(FUFOL de la Mayo Clinic ou LV5FU2) à LV5FU2 + irinotécan.
Il existe une augmentation des toxicités de grade 3-4 quand on
compare le LV5FU2 +irinotécan au LV5FU2, avec cependant
une tolérance acceptable de l’association LV5FU2 + irinotécan.
La toxicité du FUFOL de la Mayo Clinic est tout à fait similaire
à celle de l’association LV5FU2 +irinotécan. La radiothérapie
préopératoire n’augmente pas le risque de diarrhée de grade 3 - 4 ,
notamment chez les patients traités par irinotécan. L’inclusion
dans cette étude continue.
CANCERS COLORECTAUX MÉTASTASTIQUES
Chimiothérapie
Une analyse de plusieurs études randomisées (abstract 3504),
dans le cancer colorectal métastatique, de chimiothérapie à base
de 5-FU, AF et/ou irinotécan, a montré qu’il existait une étroite
corrélation entre le temps de progression tumorale (TTP) et l’OS.
Ces résultats renforcent l’hypothèse que le TTP pourrait être pris
pour objectif principal des essais thérapeutiques de phase III dans
le cancer colorectal métastatique.
L’étude OPTIMOX 1, présentée en poster/discussion, comparait
deux stratégies thérapeutiques : soit du FOLFOX4 jusqu’à
progression, soit une alternance de 6 cycles de FOLFOX7 avec
maintenance par du LV5FU2 simplifié avec réintroduction du
FOLFOX7(abstract 3525) en cas de progression sous LV5FU2
simplifié ou après 12 cycles de LV5FU2 simplifié. Les résultats
définitifs de cette étude montrent que les deux bras thérapeutiques
sont identiques en termes de taux de réponse, de survie sans pro-
gression, de durée de contrôle de la maladie et de survie globale.
La dose intensité d’oxaliplatine (130 mg/m
2
versus 85 mg/m
2
)
n’est donc pas essentielle en première ligne de chimiothérapie
chez les patients métastatiques. Du point de vue de la tolérance,
il y avait moins de neutropénie et de neuropathie de grade 3-4,
mais plus de thrombopénie avec le FOLFOX7. Quand on rentre
dans le détail de cette étude, le taux de réintroduction est de 56 %
dans le bras FOLFOX7, de 46 % dans le cadre du protocole et
de 10 % après (21 % de violation de protocole : investigateurs
qui n’ont pas réintroduit l’oxaliplatine, alors qu’ils auraient dû
le faire). Ce fait peut expliquer l’absence de différence entre les
deux bras, probablement amplifiée par le fait que, chez 27 % des
patients traités dans le cadre du bras FOLFOX4, l’oxaliplatine a
été réintroduit après une période d’arrêt. La réintroduction de
l’oxaliplatine n’augmente pas l’incidence des neuropathies. Cette
étude valide le concept d’arrêter l’oxaliplatine après 6 cycles
pour se donner la possibilité d’une réintroduction plus tardive.
Dans cette étude OPTIMOX 1, deux sous-groupes de patients
ont été étudiés. Le premier groupe concerne les patients âgés
de plus de 75 ans (abstract 3571).Il n’y avait pas de différence
de tolérance des FOLFOX, qu’ils soient 4 ou 7, entre les patients
de plus ou moins de 75 ans. Le taux de réponse et la médiane de
survie obtenus chez ces patients âgés étaient tout à fait comparables
à ceux des patients plus jeunes (âge < 76 ans). Le deuxième sous-
groupe de patients analysé était celui des patients de mauvais
pronostic, défini par des phosphatases alcalines supérieures à
trois fois la normale (abstract 3565). Il est intéressant de noter
que, dans cette population, le taux de réponse et la tolérance
étaient identiques aux patients de meilleur pronostic (phosphatases
alcalines inférieures à trois fois la normale), avec une médiane
de survie globale de 12 mois.
L’étude OPTIMOX 2/célécoxib (phase II) étudiait l’association
FOLFOX7 + célécoxib (6 cycles) avec poursuite du célécoxib
pendant une période de pause avec reprise de la chimiothérapie
à progression (abstract 3554). Le taux de réponse objective dans
110
La Lettre du Cancérologue - Volume XIII - n
o
3 - mai-juin 2004
C
A N C E R S D I G E S T I F S
Tableau II.
Capécitabine-RT Capécitabine-RT XELOX-RT XELOX-RT
J. Dunst B. Dupuis R. Glynne-Jones L.R. Duck
(abstract 3559) (abstract 3538) (abstract 3575) (abstract 3552)
Cancer du rectum (localement avancé) 79 51 62 31
T2 à T4 en écho-endoscopie
Dose de radiothérapie 50,4 Gy 45 Gy 45 Gy 45 Gy
Dose de capécitabine 825 mg/m
2
x 2/j 825 mg/m
2
x 2/j 650 mg/m
2
x 2/j 825 mg/m
2
x 2/j
Dose d’oxaliplatine 0 0 130 mg/m
2
J1-J29 50 mg/m
2
/sem.
Diarrhée grade 3-4 7 % 3 % ND 22 %
Neutropénie grade 3-4 10 % 0 % ND 1 %
CR histologique ND 24 % (12 patients sur 50) ND 1 patient sur 17
Maladie résiduelle faible (microfoci) ND 12 % ND 5 patients sur 17
ND : non déterminé

cette étude était de 47 %. Le célécoxib ne semble pas augmenter
le taux de réponse du schéma FOLFOX7. De plus, la survie sans
progression obtenue était de 6 mois, le célécoxib n’apparaissant
pas aussi actif que le schéma LV5FU2 simplifié dans la chimio-
thérapie de maintenance après 6 cycles de FOLFOX7 (compa-
raison avec les résultats de l’étude OPTIMOX 1, où la survie sans
progression du bras FOLFOX7-LV5FU2 simplifié était de
9 mois). La toxicité de l’association FOLFOX7/célécoxib est
modérée, avec, en toxicité de grade 3-4, 7,1 % de neutropénie,
21,4 % de thrombopénie et 9,5 % de neuropathie périphérique.
Dans la mesure où la majorité des patients étaient en progression
(critère RECIST) après 2 mois d’arrêt de la chimiothérapie, les
auteurs concluaient à la nécessité de nouveaux critères pour défi-
nir après une pause thérapeutique le moment de réintroduction
de la chimiothérapie.
Les résultats de l’étude EORTC 05963 (abstract 3526) compa-
rant le schéma FOLFOX2 à 4 jours de chimiothérapie chrono-
modulée associant 5-FU, AF et oxaliplatine dans des cancers
colorectaux en première ligne métastatique, ont été présentés.
Cinq cent cinquante-quatre patients ont été inclus dans cette étude
randomisée, et la conclusion des auteurs était qu’il n’existait pas
de différence en termes d’OS et de PFS entre les deux bras. La
médiane de survie était de 18,7 mois dans le bras FOLFOX2 et
de 19,6 mois dans le bras chronomodulé, avec un profil de toxi-
cité différent, mais bas pour les deux bras. Les toxicités de
g r a d e 3-4 étaient respectivement pour FOLFOX2 versus chrono-
m o d u l é : 25 % versus 7 % pour la neutropénie (p < 0,001), 1 0 , 8 %
versus 28,3 % pour la diarrhée (p < 0 , 0 0 1 ) et 6,8 % versus 13,8 %
(p < 0,001) pour la mucite.
A. Grothey (abstract 3534) a présenté les résultats en deuxième
ligne d’une étude de phase II randomisée dont le design ressem-
blait à l’étude de Tournigand et qui randomisait CAPOX (capé-
citabine + oxaliplatine) versus CAPIRI (capécitabine + irinoté-
can) en première ligne avec c r o s s o v e r en deuxième ligne. Le taux
de réponse en deuxième ligne était pour le CAPOX de 13 % et
pour le CAPIRI de 21 %, avec une PFS de respectivement 4,3 et
5,1 mois et une OS de respectivement 10,6 et 9,6 mois.
Une étude de phase II randomisée a étudié en première ligne
l’association UFT + AF +oxaliplatine (TEGAFOX) ou irinoté-
can (TEGAFIRI) (abstract 3545). Soixante-quatre patients ont
été traités avec le schéma TEGAFOX et 56 avec le schéma
TEGAFIRI. Le taux de réponse de survie sans progression
et d’OS était, dans le bras TEGAFOX, de respectivement 31%,
5 , 8 8 mois et 18,2 mois, versus 30 %, 5,75 mois et 15,4 mois dans
le bras TEGAFIRI. La tolérance des deux schémas était accep-
table avec, en ce qui concerne les toxicités de grade 3-4, 10 % de
neutropénie dans le TEGAFOX et 36 % dans le TEGAFIRI avec
11 % de diarrhée dans le bras TEGAFOX et 22 % dans le bras
TEGAFIRI.
Une analyse (abstract 3576) a comparé la tolérance et l’effica-
cité du schéma FOLFIRI (LV5FU2 simplifié + irinotécan) au
schéma LV5FU2 + irinotécan à partir des 254 patients inclus
dans deux études randomisées (Lancet 2000;355:1041-7 e t J Clin
Oncol 2004;22:229-37). Le taux de réponse objective et la
médiane de survie sans progression étaient respectivement de
33,1 % et 5,7 mois pour les patients traités par LV5FU2 + irino-
técan et de 56 % et de 8,7 mois pour ceux traités par FOLFIRI.
Bien qu’il ne s’agisse pas d’une étude randomisée, la comparai-
son statistique a été faite avec une différence significative sur les
taux de réponse (p < 0,01), sans différence significative sur la PFS
(p = 0,12) en faveur du FOLFIRI. L’analyse de la tolérance a
montré que les nausées et les vomissements étaient plus fréquents
dans le bras FOLFIRI, et que les neutropénies étaient plus fré-
quentes dans le bras LV5FU2 + CPT11.
Une étude de phase II randomisée (abstract 3599) a comparé le
FOLFOX4 au TOMOX (Tomudex
®
+oxaliplatine) en première
ligne de cancers colorectaux métastatiques (51 patients dans le
bras FOLFOX4 et 57 dans le bras TOMOX). Le taux de réponse
objective et de PFS était respectivement de 42 % et 6 mois pour
le bras FOLFOX4 et de 49 % et 3,9 mois pour le bras TOMOX.
La médiane de survie était de 15,5 mois pour le TOMOX, mais
n’était pas encore atteinte pour le bras FOLFOX4. Une étude de
phase II (cancers colorectaux métastatiques) a montré la faisabi-
lité de l’association du schéma LV5FU2 simplifié avec
260 mg/m
2
d’irinotécan (abstract 3601). Ce schéma a pu être
administré à 80 % des patients avec un bon contrôle de la mala-
die (50 % de réponse objective et 31 % de stabilisation).
L’équipe de Paul-Brousse a présenté une série de patients ayant
des métastases hépatiques initialement non résécables, rendues
résécables par une chimiothérapie avec analyse des facteurs pro-
nostiques et résultats à long terme (abstract 3550). La chimio-
thérapie a permis de pratiquer l’exérèse de métastases hépatiques
chez 13 % des patients qui avaient initialement des métastases non
résécables, avec un espoir de rémission à long terme (36 % de sur-
vie à 5 ans). Une analyse multivariée a trouvé quatre facteurs pro-
nostiques indépendants associés à une survie péjorative : primitif
rectal, nombre de métastases 3, CA 1 9 , 9 > 100 UI/l et existence
d’une carcinose péritonéale et d’adénopathies métastatiques. La
survie à 5 ans en fonction de la présence de 0, 1, 2, 3 ou 4 de ces
facteurs était respectivement de 60, 30 à 40, 10 à 18 et 0 à 3 % .
Une étude prospective de phase II (abstract 3613) a étudié l’asso-
ciation oxaliplatine + i r i n o t é c a n + LV5FU2 simplifié chez des
patients avec métastases hépatiques non résécables de cancer colo-
rectal (abstract 3613). Il s’agissait de patients qui ne pouvaient
pas initialement avoir une résection optimale de leur(s) lésion(s),
mais qui étaient susceptibles de devenir résécables en cas d’une
bonne diminution après chimiothérapie. Sur les 34 patients inclus,
25 ont été considérés comme éligibles par un comité d’experts
indépendants. Le taux de réponse objective était de 72 %. Dans
cette population qui ne pouvait pas être considérée initialement
comme optimale pour une résection, 37,5 % ont eu une résection
R0 et 91,7 % ont pu recevoir la totalité de leur traitement avec une
résection et/ou d’autres procédures d’ablation (radiofréquence ou
c r y o t h é r a p i e ) .
Bévacizumab
Les résultats de l’impact des traitements de deuxième ligne des
patients inclus dans l’étude AVF2107 (IFL + bévacizumab versus
IFL + placebo [Hurwitz H et al. N Engl J Med 350;23:2335-42])
ont été présentés (abstract 3517). Un total de 231 (56,2 %) et
111
La Lettre du Cancérologue - Volume XIII - n
o
3 - mai-juin 2004
C
A N C E R S D I G E S T I F S
... /...
 6
6
 7
7
 8
8
 9
9
1
/
9
100%