Actualités sur la gemcitabine et le pemetrexed dans les cancers intrathoraciques M

L
a gemcitabine est un des agents thérapeutiques principaux
dans la prise en charge des carcinomes bronchiques non
à petites cellules (CBNPC). Sa place est étudiée aux dif-
férents stades de ce cancer et intégrée aux autres stratégies dispo-
nibles. La gemcitabine est rejointe maintenant par le pemetrexed,
qui va probablement prendre une place importante dans la prise
en charge des cancers bronchiques. L’ASCO 2003 a été l’occasion
de faire le point sur les dernières études concernant ces médicaments.
CHIMIOTHÉRAPIE DES CARCINOMES BRONCHIQUES
NON À PETITES CELLULES :
LES DOUBLETS CONTENANT UN SEL DE PLATINE
L’association gemcitabine-cisplatine est une des pierres angu-
laires de la chimiothérapie des carcinomes bronchiques non à
petites cellules (CBNPC). Son efficacité, reproductible d’un essai
à l’autre, et son profil favorable de toxicité en font l’un des sché-
mas les plus recommandés en première ligne thérapeutique.
L’étude de l’ECOG suggère un avantage significatif de survie sans
progression ( 1 ) . Cette constatation est à la base d’une méta-analyse
de treize essais randomisés présentée lors de la World Conference
M
I S E A U P O I N T
Actualités sur la gemcitabine et le pemetrexed
dans les cancers intrathoraciques
Update on gemcitabine and pemetrexed in thoracic malignancies
D. Moro-Sibilot*
147
La Lettre du Pneumologue - Volume VII - n
o
4 - juillet-août 2004
* UF d’oncologie thoracique, CHU de Grenoble, Inserm U578.
R é s u m é :Parmi les différents doublets disponibles, l’association gemcitabine-cisplatine est l’un des acteurs majeurs du traite-
ment des carcinomes non à petites cellules. Son efficacité a été soulignée par les résultats d’une méta-analyse démontrant un
gain en matière de survie sans progression lorsqu’on la compare à des associations plus anciennes. L’association gemcitabine-
cisplatine a maintenant étendu son indication à la situation néoadjuvante. Des résultats prometteurs sont notés en mono-
thérapie chez les patients âgés et dans des associations sans sel de platine.
Le pemetrexed est un nouvel antifolate qui inhibe au moins trois systèmes enzymatiques dans la voie de synthèse des acides
nucléiques. L’association pemetrexed et cisplatine a démontré son efficacité en termes de survie et de qualité de vie dans les
mésothéliomes pleuraux. Cette association reconnue par la FDA des États-Unis représente maintenant le standard thérapeu-
tique de cette pathologie. Par ailleurs, le pemetrexed a été comparé au docétaxel dans le traitement de seconde ligne des carci-
nomes non à petites cellules et a montré une efficacité comparable et un meilleur profil de toxicité. L’effet toxique principal du
pemetrexed est la myélosuppression qui peut être très améliorée par la coprescription d’acide folique et de vitamine B12.
Mots-clés :Chimiothérapie - Pemetrexed - Gemcitabine - Cancers bronchiques - Mésothéliomes.
S u m m a r y : Among the combination chemotherapeutic regimens that can be used to treat advanced NSCLC, the gemcitabine
cisplatin doublet represents one of the major key players. Its activity has been emphasized by the results of a meta-analysis
demonstrating an improvement in time to progression when compared with older cisplatin containing combinations.
Gemcitabine has extended its use to the neoajuvant setting. Promising results have been achieved in monotherapy in the treat-
ment of elderly patients and recent doublets without cisplatin achieve encouraging results. Pemetrexed (Alimta
®
) is a multi-
targeted antifolate that inhibits at least three enzymes in the nucleic acid synthetic pathways. The US Food and Drug Adminis-
tration recently approved pemetrexed, in combination with cisplatin, for the first-line treatment of advanced malignant pleural
mesothelioma. Pemetrexed has improved the outlook for patients with mesothelioma by demonstrating a positive impact on
quality of life and by prolonging survival. Moreover, pemetrexed was recently shown to be as efficacious as docetaxel in the
second-line treatment of non-small-cell lung cancer, and its toxicity profile was preferable. The main toxicity seen with pemetrexed
is myelosuppression, which is considerably reduced by coadministration of folic acid and vitamin B12.
Keywords: Chemotherapy - Pemetrexed - Gemcitabine - Lung cancer - Mesothelioma.

on Lung Cancer (WCLC 2003) (sélection des essais disponibles
au 31/12/2002) (2). Les essais qui ont été comparés aux associa-
tions comportant de la gemcitabine sont divisée en deux sous-
groupes, le premier comportant du cisplatine seul ou associé à des
agents de première ou seconde génération tels que : étoposide, ifos-
famide, mitomycine, vinblastine (5 essais, environ 1 9 0 0 p a t i e n t s ) ,
le second avec du cisplatine associé à des agents de troisième géné-
ration tels que vinorelbine, taxanes (8 essais environ 2 6 0 0 p a t i e n t s ) .
Cette méta-analyse montre que l’association cisplatine-gemcitabine
permet une amélioration modeste mais significative de la survie
sans progression et de la survie globale (figure 1). Cette amélio-
ration est claire en ce qui concerne les associations plus anciennes
du sous-groupe 1. En ce qui concerne les associations de troisième
génération, l’association cisplatine-gemcitabine est au moins aussi
efficace en ce qui concerne la survie globale ; il existe en revanche
aussi dans ce sous-groupe une amélioration significative de la
survie sans progression. L’association gemcitabine-carboplatine
a été consacrée en 2002, avec deux présentations (3, 4) ( t a b l e a u I ).
Ainsi, R.M. Rudd (3) avait présenté la comparaison du classique
MIP au doublet gemcitabine-carboplatine, avec un avantage signi-
ficatif en termes de survie en faveur de l’association gemcitabine-
carboplatine (médiane de survie de 10,2 mois contre 6,9 mois ;
p = 0,0043). C. Sederholm (4), quant à lui, avait comparé l’asso-
ciation gemcitabine-carboplatine à la gemcitabine seule, et mon-
tré un bénéfice en termes de réponse objective, de survie sans
progression et de survie médiane. En 2003, deux études (5, 6) ont
comparé l’association gemcitabine-carboplatine répétée toutes
les trois semaines (selon des modalités proches de celles des sché-
mas de Rudd et de Sederholm) au même schéma thérapeutique
répété toutes les quatre semaines. Les données présentées dans le
tableau II montrent des résultats en faveur du schéma sur trois
semaines. L’association gemcitabine-carboplatine est donc une
bonne alternative à l’association gemcitabine-cisplatine.
La gemcitabine a été étudiée avec un autre sel de platine, l’oxali-
platine. L’association gemcitabine-oxaliplatine (GEMOX) est
déjà reconnue en oncologie digestive mais encore non évaluée
en oncologie thoracique. L. Crino (7) a présenté une étude chez
54 patients traités par gemcitabine 1 000 mg/m
2
à J1, J8 et oxali-
platine 130 mg/m
2
à J1 tous les 21 jours. Cette association, dont
il faut poursuivre l’évaluation dans cette indication, apparaît
d’ores et déjà comme efficace et bien tolérée.
Une approche combinée associant gemcitabine-carboplatine et
un anticorps monoclonal anti-EGFR (cetuximab) a été présen-
tée (8). Cette association est bien tolérée, les principaux effets
secondaires restent ceux que l’on observe avec chacun des médi-
caments utilisé isolément, sans synergie de toxicité.
Le pemetrexed est un antimétabolite inhibant trois enzymes clés
du métabolisme des folates (DHFR, TS et GARFT) et prochai-
nement disponible pour les études cliniques. Son rôle en onco-
logie thoracique s’avère prometteur. Son activité sur les CBNPC
en monothérapie a été montrée (9-12).
M
I S E A U P O I N T
148
La Lettre du Pneumologue - Volume VII - n
o
4 - juillet-août 2004
Figure 1. Méta-analyse comparant l’association gemcitabine-sel de pla-
tine à d’autres associations de chimiothérapie. Les données à gauche de
la ligne médiane sont en faveur de l’association gemcitabin-sel de platine.
Tableau I. Études comparant l’association gemcitabine-carboplatine soit à la gemcitabine seule, soit au schéma MIP.
Efficacité C. Sederholm et al. (ASCO 2002 ; abstract 1162) R.M. Rudd et al. (ASCO 2002 ; abstract 1164)
Traitement Gemcitabine 1 250 mg/m
2
Gemcitabine 1 250 mg/m
2
Gemcitabine 1 200 mg/m
2
Mitomycine 6 mg/m
2
J1, J8
J1, J8 J1, J8 J1, J8 Ifosfamide 3 mg/m
2
J1
Carboplatine ASC 5 J1 Cycle 3 semaines Carboplatine ASC 5 J1 Cisplatine 50 mg/m
2
J1
Cycle 3 semaines Cycle 3 semaines Cycle 3 semaines
Nombre de patients 164 170 212 210
Taux de RO 29,6 %* 11,5 % 41 % 41 %
Médiane de SSP 6 mois* 4 mois 5,4 mois 5 mois
Médiane de SG 10 mois* 9 mois 10,2 mois* 6,9 mois
Survie à 1 an 41 % 32 % 38 % 28 %
RO : réponse objective ; SSP : survie sans progression ; SG : survie globale ; * p < 0,05.

Une étude ( 1 3 ) associe ce médicament au carboplatine ou à l’oxali-
platine. Ces deux associations se distinguent, dans ce travail, par
un taux de réponse proche de 30 %, qui est comparable à celui
des doublets modernes contenant du cisplatine, tout en présentant
une toxicité hématologique et non hématologique moins impor-
tante. Ces résultats montrent la bonne capacité d’association du
pemetrexed.
CHIMIOTHÉRAPIE DES CARCINOMES BRONCHIQUES
NON À PETITES CELLULES : DOUBLETS SANS CISPLATINE
Depuis les comparaisons de chimiothérapie des années 90, le trai-
tement de référence des CBNPC est un doublet comportant un sel
de platine. Cette association avec un sel de platine, bien codifiée,
reste néanmoins complexe d’utilisation. En effet, la nécessité
d’une hydratation abondante et les effets secondaires du cispla-
tine restreignent souvent son utilisation à l’hospitalisation conti-
nue. L’utilisation ambulatoire, préférable en termes de qualité de
vie pour le patient et plus simple en termes d’organisation, fait
alors appel au carboplatine. L’administration du carboplatine est
plus simple mais son équivalence au cisplatine n’est que suppo-
sée, sans avoir jamais été vraiment démontrée. Il est donc tentant
d’essayer d’associer les nouveaux médicaments de chimiothéra-
pie et de se passer du cisplatine. Plusieurs essais ont étudié les
doublets sans platine associant gemcitabine et docétaxel. V. G e o r -
goulias (14) a été le premier à comparer l’association gemcita-
bine-docétaxel à l’association docétaxel-cisplatine, ces deux
modalités thérapeutiques ayant des résultats relativement com-
parables en matière de réponse et de survie. En 2002, S. Kako-
lyris (15) avait présenté les résultats préliminaires d’une étude
de phase III multicentrique randomisée comparant l’association
gemcitabine J1 et J8 et docétaxel J8 au schéma vinorelbine J1 et
J8 et cisplatine J8. Les cycles de traitement ont été renouvelés
tous les 21 jours. Deux cent cinquante et un patients (219 éva-
luables) ont été randomisés. L’étude montrait des résultats com-
parables entre l’association gemcitabine-docétaxel et vinorelbine-
cisplatine. Les résultats de l’étude française pilotée par J.L. P u j o l
comparant dans une étude de phase III, gemcitabine 1 0 0 0 m g / m
2
J1 et J8 associé à docétaxel 85 mg/m
2
J8 à l’association vinorel-
bine 30 mg/m
2
hebdomadaire et cisplatine 100 mg/m
2
J1 ont été
présentés lors de la WCLC ( t a b l e a u I I I ) ( 1 6 ). Cette étude ne
démontre pas d’avantage net en termes de survie sans progres-
sion du doublet “sans platine”. En revanche, elle montre sa bien
meilleure tolérance par rapport au doublet cisplatine-vinorelbine.
Les résultats ont été présentés en 2003 lors de la World Confe-
rence on Lung Cancer.
En 2003 également, plusieurs études se sont intéressées à cette
association, trois de phase II ( 1 7 - 1 9 ) et une de phase III ( 2 0 ) . Cette
dernière étude clinique compare gemcitabine-cisplatine à gemci-
tabine-docétaxel, mais les résultats préliminaires présentés sont
trop peu matures pour être commentés. Par contre, les principales
caractéristiques des trois études de phase II sont, elles, présentées
dans le tableau IV. Les résultats de ces différentes phases II sont
assez hétérogènes et ne permettent pas de conclure sur l’utilité de
ces associations. En revanche, l’association concomitante gemci-
tabine à J1 et J8 et docétaxel est possible sans excès de toxicité.
Y. Horio ( 2 1 ) a présenté une comparaison de l’association gemci-
tabine 1 000 mg/m
2
J1, J8 et carboplatine aire sous la courbe
(ASC) 5 J1 dans un cycle de trois semaines (64 patients) à l’asso-
ciation sans sel de platine gemcitabine 1 000 mg/m
2
J 1 , J8 et vino-
relbine 25 m g / m
2
J 1 , J8 dans un cycle de trois semaines
(64 patients).
Les résultats de cette étude ressemblent beaucoup à ceux d’autres
études comparant un doublet traditionnel à un doublet sans sel
149
La Lettre du Pneumologue - Volume VII - n
o
4 - juillet-août 2004
Tableau II. Comparaison de deux schémas de gemcitabine-carboplatine répétés toutes les trois semaines ou toutes les quatre semaines.
Efficacité C.K. Obasaju et al. (ASCO 2003; abstract 2603) G.A. Masters et al. (ASCO 2003; abstract 2670)
Traitement Gemcitabine 1 100 mg/m
2
Gemcitabine 1 000 mg/m
2
Gemcitabine 1 100 mg/m
2
Gemcitabine 1 000 mg/m
2
J1, J8 J1, J8 J1, J8 J1, J8
Carboplatine ASC 5 J8 Carboplatine ASC 5 J1 Carboplatine ASC 5 J8 Carboplatine ASC 5 J1
Cycle 4 semaines Cycle 3 semaines Cycle 4 semaines Cycle 3 semaines
Nombre de patients 258 215 48 52
Taux de RO 22,8 % 32,7 % 23 % 40 %
Médiane de SSP – – 3,7 mois 4,9 mois
Médiane de survie globale – – 8,7 mois 7,3 mois
Neutropénie grade 3/4 9,1 % 10,7 % 13 % 24 %
Thrombopénie grade 3/4 8,3 % 14,4 % 18 % 26 %
RO : réponse objective ; SSP : survie sans progression.
Tableau III. Comparaison docétaxel-gemcitabine à vinorelbine et cis-
platine (* p < 0,01).
Gem-Doc Cis-V
(n = 155) (n = 156)
Décès 131 130
Médiane (mois) IC 95 % 11,3 (10,0-12,6) 9,8 (8,2-12,0)
Survie à 1 an (%) 47 43
Réponse (%) 31 35,9
Effet indésirable sérieux (%) 21,9 35,9*
Neutropénie grade 3-4 (%) 52,3 83,4

de platine. En effet, la tolérance est meilleure avec le doublet
gemcitabine-vinorelbine, puisqu’il y a significativement moins
de neutropénies, thrombopénies et anémies de grade 3 - 4 . D ’ a u t r e
part, on retrouve une absence de différence significative en termes
de survie entre les modalités thérapeutiques “avec et sans” sel de
platine. Cette absence de significativité en termes de survie res-
semble malheureusement à celle des autres études comparatives
où le doublet “sans cisplatine” n’améliore pas la survie des
patients.
Une autre étude de phase II ( 2 2 ) comparant vinorelbine-cisplatine,
gemcitabine-cisplatine et gemcitabine-vinorelbine conduit à des
conclusions similaires, et rejoint celles de l’étude publiée par
C. Gridelli (23).
L’avenir nous dira si ces schémas sont à même de nous faire sortir
de l’ère des doublets contenant du cisplatine.
CHIMIOTHÉRAPIE DES PATIENTS ÂGÉS
La proportion des sujets âgés augmente. Le cancer est avant tout
une maladie liée au vieillissement. Celui-ci s’accompagne d’une
altération progressive, mais variable, des fonctions de l’orga-
nisme, ce qui entraîne des modifications significatives dans le
métabolisme et la pharmacocinétique des médicaments. À ce jour,
il n’y a pas de standard consensuel de traitement du cancer bron-
chique pour les patients âgés. Cependant, plus de 60 % des cancers
bronchiques apparaissent chez des patients de plus de 60 ans (dont
environ un tiers chez les personnes âgées de 70 ans et plus). Peu
d’études se sont intéressées spécifiquement au traitement des
patients âgés, et un certain nombre des faits connus actuellement
sont le résultat de l’analyse du sous-groupe des patients âgés au
sein d’une population de patients cancéreux de tous âges.
La grande majorité des phases III disponibles ont été réalisées en
Italie. De ces études, il ressort que la monochimiothérapie par
gemcitabine ou vinorelbine est probablement le traitement le plus
adapté. D’autre part, le fait d’associer gemcitabine et vinorelbine
n’améliore pas l’efficacité comparativement à une monochimio-
thérapie par gemcitabine ou vinorelbine (24). Une monochimio-
thérapie reste donc pour l’instant un standard pour les CBNPC
évolués des patients âgés. En 2003, une étude française (25) a
comparé une monothérapie par gemcitabine 1 0 0 0 m g / m
2
J 1 , J 8 , J15 dans un cycle de quatre semaines à la gemcitabine
1 125 mg/m
2
J1, J8 dans un cycle de trois semaines. Les résul-
tats de cette comparaison sont présentés dans le tableau V. La
dose-intensité administrée est élevée et similaire dans les deux
groupes de patients. Le profil de toxicité est à peu près similaire,
sauf en ce qui concerne les thrombopénies, les diarrhées et les
toxicités de grade 3-4, qui sont sensiblement plus fréquentes, mais
sans différence statistiquement significative, dans le groupe de
patients traités par le schéma “4 semaines”. Le profil d’efficacité
favorise le schéma “3 semaines”, qui apparaît donc comme le
schéma le mieux adapté.
CHIMIOTHÉRAPIE DES CARCINOMES BRONCHIQUES
NON À PETITES CELLULES (CBNPC)
EN SITUATION PÉRI-OPÉRATOIRE
Une méta-analyse des études randomisées de chimiothérapie réa-
lisées entre janvier 1965 et décembre 1991 (26) a montré que la
chimiothérapie adjuvante réduisait le risque de décès de 3 % à
2 ans et de 5 % à 5 ans. Cette méta-analyse a été à la base de l’étude
internationale multicentrique IALT (International Adjuvant Lung
Trial), présentée par T. Le Chevalier (27), et étudiant, chez des
patients opérés, l’intérêt d’une chimiothérapie adjuvante. Le
choix du traitement était laissé à l’initiative de chaque centre
investigateur, tant en ce qui concerne la stratégie en matière de
radiothérapie adjuvante que le choix des médicaments de chimio-
thérapie. Cependant, la dose totale prévue de cisplatine devait
être de 300 à 400 mg/m
2
et le cisplatine devait être associé soit à
l’étoposide, soit à un vinca-alcaloïde. Mille huit cent soixante-
sept patients ont été randomisés avec et sans chimiothérapie adju-
vante. La chimiothérapie adjuvante, dans cette grande étude ran-
domisée, améliore la survie à 5 ans de 5 %. Cette étude sera un
des éléments de réflexion pour la définition d’un nouveau stan-
dard dans les stades opérables. Toutefois, les médicaments asso-
ciés au cisplatine étaient l’étoposide ( 5 6 %), la vinorelbine (27 % ) ,
M
I S E A U P O I N T
150
La Lettre du Pneumologue - Volume VII - n
o
4 - juillet-août 2004
Tableau IV. Schéma thérapeutique et caractéristiques de survie de plusieurs études de phase II associant gemcitabine et docétaxel.
Abstract Nombre de patients Gemcitabine Docétaxel RO Médiane de survie
(ASCO 2003)
2785 22 800 mg/m
2
J1, J8 40 mg/m
2
J1, J8 41 % 8,6 mois
2846 26 1 000 mg/m
2
J1, J8 35 mg/m
2
J1, J8 45 % 12,5 mois
2698 43 1 000 mg/m
2
J1, J8 36 mg/m
2
J1, J8 10 % 7,75 mois
Tableau V. Comparaison gemcitabine-monothérapie chez les per-
sonnes âgées selon un protocole répété toutes les trois semaines ou
toutes les quatre semaines.
E. Quoix et al. Gemcitabine Gemcitabine
(ASCO 2003; abstract 2530) 4 semaines 3 semaines
Nombre de patients 42 39
Âge 74,9 ans 75,2 ans
Sexe masculin/féminin 36/6 31/8
Stade (IIIb/IV) 16/26 11/28
Indice de Karnofsky (60-70/> 80) 8/34 11/28
Pourcentage de réponses objectives 14,3 % 28,2 %
Temps jusqu’à progression 2,7 mois 3 mois
Médiane de SSP 5,1 mois 6,8 mois

la vinblastine (11 %) et la vindésine (6 %). Actuellement, l’utili-
sation de chimiothérapies plus efficaces et moins toxiques serait
à recommander. On sait que la chimiothérapie néoadjuvante amé-
liore la survie dans les petits stades I et II depuis l’étude de
A. Depierre (28).On sait également que la chimiothérapie adju-
vante l’améliore aussi. Des essais sont en cours, notamment
l’essai IFCT 0002 comparant, d’une part, deux stratégies diffé-
r e n t e s : l’une à la fois pré- et postopératoire et l’autre uniquement
préopératoire ; d’autre part, deux associations de chimiothérapie
d i f f é r e n t e s : paclitaxel-carboplatine et gemcitabine-cisplatine.
L’association gemcitabine-cisplatine a été l’objet d’une évaluation
approfondie en situation néoadjuvante. Plusieurs essais de phase I I
ont été conduits chez des patients ayant un CBNPC de stade IIIa
ou IIIb. Un taux important de réponse allant jusqu’à 70 % ( 2 9 - 3 2 ) ,
avec un profil de toxicité acceptable, a été observé. Une étude
italienne (33) a évalué l’association gemcitabine-cisplatine chez
62 patients porteurs de stades IIIa N2/IIIb. Le protocole de trai-
tement comportait deux cycles de gemcitabine 1 2 5 0 m g / m
2
J 1 , J 8
et cisplatine 75-100 mg/m
2
J8 répétés toutes les trois semaines.
Après deux cycles de traitement, les patients étaient réévalués. C e u x
en réponse ou stabilisés continuaient alors un troisième cycle de
chimiothérapie, puis soit étaient opérés, soit étaient irradiés, soit,
enfin, sortaient du protocole dans le cas d’une progression. Cette
nouvelle étude confirme l’efficacité importante de ce protocole
en situation néoadjuvante, avec un taux de réponse de 68,5 % qui
se compare favorablement avec ceux des études antérieures sur
le même sujet ( t a b l e a u V I ) . La tolérance au traitement a été
bonne.
CHIMIOTHÉRAPIES DE SECONDE LIGNE
La chimiothérapie de seconde ligne est souvent proposée aux
patients en rechute ou en progression après une première ligne de
chimiothérapie. En dépit de sa fréquence, les recommandations
thérapeutiques à ce stade sont encore mal définies, une des raisons
principales en étant le petit nombre d’agents thérapeutiques effi-
caces à ce moment de la maladie. Le docétaxel est actuellement
le seul médicament enregistré dans cette indication dans les d i f f é-
rentes agences du médicament européennes et nord-américaines.
Une étude (34) compare, chez 571 patients en progression après
une première ligne de chimiothérapie, l’administration de docéta-
xel à celle du pemetrexed. Dans cette étude, la plus grande réa-
lisée en seconde ligne, le pemetrexed est comparable au docé-
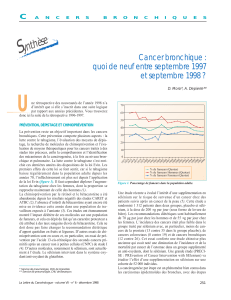
taxel en termes de réponse et de survie ( t a b l e a u V I I ; figure 2 ).
C e t t e efficacité est obtenue avec moins d’effets secondaires, que
151
La Lettre du Pneumologue - Volume VII - n
o
4 - juillet-août 2004
Tableau VI. Principales études de l’association gemcitabine-cisplatine utilisée en néoadjuvant.
Efficacité C.H. Yang (29) M. Van Kooten (30) M. Van Zandwijk (31) M.R. Migliorino (32) S. Antonio et al.
(ASCO 2003; abstr. 2669)
Traitements Gemcitabine Gemcitabine Gemcitabine Gemcitabine Gemcitabine
1 000 mg/m
2
1 250 mg/m
2
1 000 mg/m
2
1 250 mg/m
2
1 250 mg/m
2
J1, J8, J15 J1, J8, J15 J1, J8, J15 J1, J8 J1, J8
Nombre de patients Cisplatine 90 mg/m
2
J15 Cisplatine 100 mg/m
2
J1 Cisplatine 100 mg/m
2
J2 Cisplatine 70 mg/m
2
J2 Cisplatine 75-100 mg/m
2
J8
Cycles 4 semaines 4 semaines 4 semaines 3 semaines 3 semaines
Nombre de patients 52 29 47 70 62
RO clinique 63,5 % 62 % 70,2 % 57,1 % 68,5 %
RO pathologique 5 % (RC) 38,8 % (RC + RP) 53 % (RC + RP) 23 % (RC + RP) –
Survie à 1 an 66 % 61 % 69 % 67 % 77 %
RO : réponse objective ; RC : réponse complète ; RP : réponse partielle.
Figure 2. Courbe de survie sans progression des patients traités par
pemetrexed ou docétaxel.
Tableau VII. Caractéristiques cliniques, thérapeutiques et de survie
des deux groupes de patients traités dans l’étude comparant docétaxel
et pemetrexed en seconde ligne thérapeutique.
N.H. Hanna et al. (34) Docétaxel Pemetrexed
(n = 288) (n = 283)
Âge médian 57 ans 59 ans
ECOG PS 0,1 (%) 13/87 11,7/88,3
Stade (IV) 74,7 % 74,9 %
RC ou RP en 1
re
ligne 36,5 % 35,6 %
Pourcentage
de réponses/stabilisations 8,8/46,4 % 9,1/45,8 %
Médiane de survie 2,9 mois 2,9 mois
Survie à 1 an 29,7 % 29,7 %
RC : réponse complète ; RP : réponse partielle
.
 6
6
 7
7
 8
8
1
/
8
100%