Cancers digestifs RÉTROSPECTIVE 2011 Gastrointestinal cancers: 2011 highlights Cancer colorectal

36 | La Lettre du Cancérologue • Vol. XXI - n° 1 - janvier 2012
RÉTROSPECTIVE 2011
Cancers digestifs
Gastrointestinal cancers: 2011 highlights
Coordination : C. Tournigand*
* Service de gastroentérologie,
hôpital Saint-Antoine, Paris.
** Service de médecine interne
et d’oncologie médicale,
hôpital Ambroise-Paré, Boulogne-
Billancourt.
Cancer colorectal
A. Lièvre**
Cancer colorectal métastatique
◆Traitement séquentiel versus traitement
combiné d’emblée avant l’ère des thérapies
ciblées : suite et fin !
Les résultats de l’essai FFCD 2000-05 viennent
enfin d’être publiés ! Cet essai français de phase III,
multicentrique, randomisé et réalisé entre 2002
et 2006 avait pour objectif de comparer un traite-
ment séquentiel débutant par une fluoropyrimidine
en monothérapie suivie d’une bichimiothérapie à un
traitement combiné par bichimiothérapie d’emblée
chez des patients ayant un cancer colorectal
métastatique (CCRm) non résécable (1). Au total,
410 patients ont été randomisés pour recevoir
soit un traitement séquentiel par LV5FU2 (acide
folinique + 5-FU) simplifié en première ligne puis
FOLFOX6 (acide folinique + 5-FU + oxaliplatine) en
deuxième ligne et FOLFIRI (acide folinique + 5-FU +
irinotécan) en troisième ligne (n = 205), soit un
traitement combiné d’emblée par FOLFOX6 puis
FOLFIRI en deuxième ligne (n = 205). Alors que la
survie sans progression (SSP) médiane (7,6 versus
5,3 mois ; p = 0,0004) et le taux de réponse objec-
tive (RO) [58 versus 24 % ; p < 0,0001] après la
première ligne étaient logiquement meilleurs dans
le bras combiné, ni la SSP médiane après 2 lignes
de chimiothérapie (CT), objectif principal de l’essai
(10,5 versus 10,3 mois ; p = 0,61), ni la survie globale
(SG) [16,2 versus 16,4 mois ; p = 0,85] n’étaient signi-
ficativement différentes entre les 2 bras. Les 6 décès
liés à la toxicité observés sont tous survenus dans le
bras combiné, dans lequel la survenue d’une toxicité
sévère (grade 3-4) hématologique et non hémato-
logique au cours de la première ligne de CT était
significativement plus importante que dans le bras
séquentiel (40 versus 5,9 % ; p < 0,0001 et 91 versus
12,8 % ; p < 0,0001 respectivement).
Après les essais FOCUS et CAIRO précédemment
publiés, ce troisième essai montre qu’un traitement
séquentiel débutant par une simple fluoropyrimidine
suivie d’une bichimiothérapie lors de la progression
est aussi efficace et moins toxique qu’une bichimio-
thérapie d’emblée. Ce traitement séquentiel est donc
envisageable chez des patients ayant un CCRm, à
condition que celui-ci ne soit ni résécable, ni mena-
çant, ni symptomatique. Cet essai, réalisé avant
l’ère des thérapies ciblées, pourrait servir de base à
d’autres essais stratégiques associant au traitement
séquentiel un anticorps anti-Epidermal Growth Factor
Receptor (EGFR) [en l’absence de mutation de KRAS]
ou le bévacizumab, puisque plusieurs études ont
montré l’efficacité et la bonne tolérance de telles
associations.
◆Quoi de neuf du côté des anticorps anti-EGFR
en première ligne ?
Le cétuximab a fait l’objet de plusieurs publications
en 2011.
Tout d’abord, l’actualisation des données des essais
CRYSTAL et OPUS a permis de montrer qu’avec
un statut KRAS disponible pour désormais 89 %
des 1 098 patients de l’essai CRYSTAL et 93 %
des 335 patients de l’essai OPUS, le bénéfice en
faveur de la combinaison cétuximab + FOLFIRI ou
FOLFOX était confirmé pour la SSP et la RO chez les
patients à KRAS sauvage (2, 3) [tableau I]. De plus,
après un suivi médian de 46 mois, il y avait une
amélioration significative de la SG médiane dans
l’essai CRYSTAL dans le bras cétuximab + FOLFIRI
(23,5 versus 20,0 mois ; p = 0,0093), tandis que
l’allongement de la SG dans le bras cétuximab +
FOLFOX de l’essai OPUS n’était pas significativement
différent. Ces 2 nouvelles publications confirment
donc l’intérêt du cétuximab en première ligne chez
les patients ayant une tumeur à KRAS sauvage.
Plus surprenants sont les résultats de l’essai COIN,
déjà rapportés à l’European Society for Medical Onco-
logy (ESMO) en 2009 et publiés cette année dans le
C. Tournigand

La Lettre du Cancérologue • Vol. XXI - n° 1 - janvier 2012 | 37
Résumé
Dans le domaine des tumeurs digestives, l’année 2011 aura été marquée par la publication de grands
essais qui feront date car ils constituent des avancées majeures. Cela concerne le traitement des tumeurs
endocrines pancréatiques, avec le sunitinib et l’évérolimus, et le cancer du pancréas avec la publication de
l’essai FOLFIRINOX, 3 essais positifs qui changent d’ores et déjà les habitudes de traitement. On retiendra
également l’arrivée du panitumumab dans l’arsenal thérapeutique des tumeurs colorectales avancées,
enpremière ligne en association avec le FOLFOX et en deuxième ligne en association avec le FOLFIRI.
Enfin, un nouvel antiangiogénique, l’aflibercept (VEGF-trap), fait son entrée parmi les médicaments dont
il faudra tenir compte à l’avenir dans la stratégie thérapeutique des cancers colorectaux métastatiques.
Mots-clés
Cancers colorectaux
Cancers de l’estomac
Cancers du pancréas
Tumeurs endocrines
digestives
Summary
In the field of gastrointestinal
tumors, 2011 was marked by
the publication of large trials
landmark as major advances.
It concerns the treatment of
pancreatic endocrine tumors,
with sunitinib and evero-
limus, and pancreatic cancer
with the final results of the
FOLFIRINOX study. These three
positive studies have already
changed our daily practice.
The arrival of panitumumab
in the therapeutic armamen-
tarium of advanced colorectal
tumors as first-line in combina-
tion with FOLFOX and second
line with FOLFIRI is also an
important point. Finally, a new
anti-angiogenic, aflibercept
(VEGF-trap), joined the drugs
to be taken into account in the
future therapeutic strategy for
metastatic colorectal cancer.
Keywords
Colorectal cancers
Gastric cancers
Pancreatic cancers
Neuroendocrin tumors
Lancet (4). Cet essai britannique, de phase III, rando-
misé, à 3 bras comparait, chez des patients ayant
un CCRm en première ligne, une CT continue par
FOLFOX4 ou XELOX (capécitabine + oxali platine)
[bras A ; n = 815], une CT identique + cétuximab
hebdomadaire (bras B ; n = 815) et une CT identique
à celle du bras A mais intermittente de 12 semaines
avec reprise en cas de progression (bras C ; n = 815).
La tumeur de 81 % des patients a été analysée : 43 %
portaient une mutation de KRAS. Chez les patients
à KRAS sauvage, l’objectif principal n’était pas atteint,
puisque la SG médiane n’était pas différente entre
les bras A et B (17,9 versus 17,0 mois ; p = 0,67),
ni la SSP médiane (8,6 versus 8,6 mois ; p = 0,60).
La différence n’était pas plus significative entre les
2 bras chez les patients ayant un statut KRAS/BRAF/
NRAS sauvage. Le seul bénéfice observé a été un taux
de réponse significativement augmenté (57 versus
64 % ; p = 0,049). La plupart des effets indésirables
de grades 3-4 non hématologiques (notamment
cutanés et digestifs) étaient significativement plus
fréquents dans le bras cétuximab. Par ailleurs, la
toxicité digestive était plus élevée chez les patients
traités par XELOX + cétuximab que chez les patients
traités par FOLFOX + cétuximab, ce qui a conduit à
une réduction systématique de la dose de capéci-
tabine à 850 mg/m2 × 2/j au cours de l’étude. Seul
le sous-groupe des patients combinant à la fois un
statut KRAS sauvage, un seul site métastatique et
traités par 5-FU plutôt que par capécitabine avait une
meilleure SSP dans cette étude (n = 96 ; HR = 0,55 ;
IC95 : 0,35-0,87 ; p = 0,011).
La forte proportion de patients traités par capéci-
tabine (66 %) par rapport aux patients traités par
5-FU en perfusion pourrait donc, en partie, expliquer
les résultats négatifs de cette étude, ainsi que la
relativement faible dose-intensité de la capécitabine
induite par sa toxicité digestive en association avec
le cétuximab et la diminution significative de l’accès
à une CT de seconde ligne dans le bras cétuximab.
Le panitumumab vient, quant à lui, de faire son
entrée dès la première ligne du traitement du CCRm,
puisqu’il vient d’obtenir l’autorisation de mise sur
le marché (AMM) européenne en association avec
le FOLFOX en première ligne et avec le FOLFIRI en
deuxième ligne chez les patients à KRAS sauvage 1 an
après la publication l’année dernière de 2 grandes
études randomisées de phase III internationales,
l’étude PRIME et l’étude 20050181, qui ont inclus
respectivement 1 186 et 1 183 patients. L’analyse
finale de l’étude PRIME, présentée au congrès de
l’American Society of Clinical Oncology (ASCO®)
cette année (5), apporte un élément nouveau : un
bénéfice désormais significatif de l’ajout du panitu-
mumab à une CT de première ligne par FOLFOX4
en termes de RO (tableau II). Le bénéfice en SSP
est, quant à lui, confirmé avec des chiffres un peu
Tableau II. Résultats de l’étude PRIME en première ligne chez les patients à KRAS sauvage.
KRAS sauvage (n=656) FOLFOX FOLFOX + panitumumab p
Réponse objective (%) 48 57 0,018
Survie sans progression (mois) 8,6 10 0,009
Survie globale (mois) 19,7 23,9 0,17
Tableau I. CRYSTAL et OPUS : données actualisées et survie globale (2, 3).
CRYSTAL
KRAS sauvage (n=666)
OPUS
KRAS sauvage (n=179)
FOLFIRI
(n=350)
FOLFIRI+ cétuximab
(n=316)
p FOLFOX
(n=97)
FOLFOX+ cétuximab
(n=82)
p
Réponse objective (%) 39,7 57,3 < 0,001 34 57 0,0027
Survie sans progression
médiane (mois) 8,4 9,9 0,0012 7,2 8,3 0,0064
Survie globale médiane
(mois) 20 23,5 0,0093 18,5 22,8 0,39
KRAS disponible pour 1 063 (89 %)
des1 098patients
Suivi médian : 46 mois (29 mai 2009)
KRAS disponible pour 315 (93 %)
des335patients
Suivi allongé (30 novembre 2008)

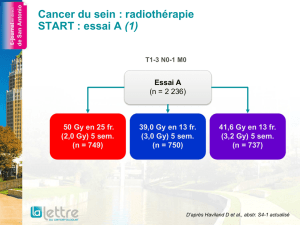
Figure 1. Schémas et objectifs des études CONFIRM-1 et CONFIRM-2.
CONFIRM-1
CCRm
Première ligne
Objectif principal : survie sans progression
Objectif principal : survie globale
* PTK/ZK : 1 250 mg/j en 1 prise.
n = 1 188
n = 855
FOLFOX4 + PTK/ZK*
(n = 585)
FOLFOX4 + PTK/ZK*
(n = 426)
FOLFOX4 + placebo
(n = 583)
FOLFOX4 + placebo
(n = 429)
Stratification selon :
– le PS OMS (0 versus 1-2)
– le taux de LDH (≤ versus > 1,5 N)
CONFIRM-2
CCRm
Deuxième ligne
R
R
38 | La Lettre du Cancérologue • Vol. XXI - n° 1 - janvier 2012
Cancers digestifs
RÉTROSPECTIVE 2011
meilleurs que ceux initialement rapportés dans la
publication initiale de PRIME du Journal of Clinical
Oncology en 2010. La SG, bien qu’allongée, n’est
toujours pas significativement différente, peut-être
parce que 25 % des patients du bras témoin (contre
13 % des patients du bras panitumumab) ont reçu
un anti-EGFR après la première ligne. Enfin, le taux
de résection secondaire des métastases hépatiques
semblait meilleur dans le bras combinant panitu-
mumab et FOLFOX (28 versus 18 %).
◆Y a-t-il de la place pour d’autres
antiangiogéniques que le bévacizumab ?
Depuis l’avènement du bévacizumab dans le trai-
tement du CCRm, plusieurs molécules ayant des
propriétés antiangiogéniques ont fait l’objet d’une
évaluation. On se souvient des résultats déce-
vants l’année dernière du cédiranib dans les essais
HORIZON II et III présentés au congrès de l’ESMO
et du sunitinib rapportés à l’ASCO®, résultats non
publiés à ce jour. Les inhibiteurs de tyrosine kinase
(ITK) ciblant, entre autres, les récepteurs du Vascular
Endothelial Growth Factor (VEGF), n’ont malheu-
reusement encore pas été à l’honneur cette année.
Les 2 grandes études randomisées de phase III
CONFIRM-1 et CONFIRM-2 ayant évalué le vatalanib
(PTK/ZK) en association au FOLFOX4 en première
et deuxième ligne du CCRm et qui ont (enfin !) été
publiées sont, elles aussi, négatives (6, 7). En effet,
ces 2 études (dont le schéma et les objectifs sont
résumés dans la figure 1) montrent des résultats
pratiquement identiques en ce qui concerne leurs
critères de jugement principaux, ainsi que pour la
majorité des critères analysés, dont le taux de RO,
le temps jusqu’à détérioration de l’état général et
le temps jusqu’à une perte de poids de plus de 5 %
(tableau III). Le seul bénéfice retrouvé a été une
amélioration significative de la SSP dans le bras
PTK/ZK de l’étude CONFIRM-2, en particulier pour
Tableau III. Résultats des études CONFIRM-1 et CONFIRM-2.
CONFIRM-1 CONFIRM-2
FOLFOX4 + PTK/ZK
(n= 585)
FOLFOX4 + placebo
(n = 583)
FOLFOX4 + PTK/ZK
(n = 426)
FOLFOX4 + placebo
(n = 429)
Survie globale (mois)
Médiane 21,4 20,5 13,1 11,9
HR=1,08; IC: 0,94-1,24 ; p=0,26 HR=1,0; IC: 0,87-1,16 ; p=0,95
Patients avec LDH>1,5N 14,8 14,6 9,7 7,3
HR=1,04; IC: 0,82-1,33 ; p=0,75 HR=0,82; IC: 0,63-1,06 ; p=0,13
Survie sans progression (mois)
Médiane 7,7 7,6 5,6 4,2
HR=0,88; IC: 0,74-1,03 ; p=0,118 HR=0,83 ; IC: 0,71-0,96 ; p=0,013
Patients avec LDH>1,5N 7,7 5,8 NP NP
HR=0,67; IC: 0,49-0,91 HR=0,63; IC: 0,48-0,83 ; p<0,001
Taux de réponse (%) NP NP NP NP
NS NS
Temps médian jusqu’à
détérioration de l’état
général selon OMS
HR=1,55; IC: 1,16-2,8 ; p<0,003 HR=2,23; IC: 1,60-3,10
Temps médian jusqu’à perte
de poids ≥ 5%
HR=1,91; IC: 1,58-2,3 ; p<0,001 HR=1,83; IC: 1,46-2,29
NP : non précisé ; NS : non significatif ; PTK/ZK: vatalanib.

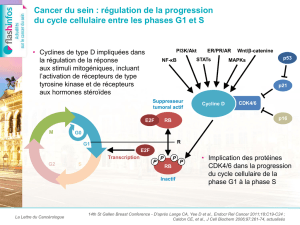
Figure 2. Résultats de survie de l’étude VELOUR.
100
100
Survie sans progression (%)Survie globale (%)
Mois
Mois
FOLFIRI + aflibercept (n = 612)
FOLFIRI + placebo (n = 614)
FOLFIRI + aflibercept (n = 612)
FOLFIRI + placebo (n = 614)
HR = 0,758 ; IC99,99 : 0,578-0,995 ; p = 0,00007
HR = 0,82 ; IC99,99 : 0,71-0,94 ; p = 0,0032
60
60
80
80
40
40
20
20
0
0
0
0
3
3
6
6
9
9
18
18
12
12
21
21
15
15
24
24 33
27
27 36
30
30 39
4,67
12,06
6,9
13,50
La Lettre du Cancérologue • Vol. XXI - n° 1 - janvier 2012 | 39
RÉTROSPECTIVE 2011
le sous-groupe de patients ayant plus de 1,5 fois
la normale de lactate déshydrogénases (LDH). Sur
le plan de la tolérance, les 2 essais montrent une
toxicité significativement plus importante dans le
bras PTK/ZK, que l’on prenne en compte les effets
indésirables dans leur ensemble, les effets indési-
rables sévères de grades 3-4 (hypertension artérielle
[HTA], diarrhée, nausées, fatigue et déshydratation
principalement) ou les effets indésirables graves.
Cela a conduit à un taux d’arrêt thérapeutique pour
cause de toxicité plus élevé dans le bras PTK/ZK.
Cet ITK n’apporte donc clairement aucun bénéfice
cliniquement significatif dans le CCRm.
L’association sorafénib + FOLFOX6 modifié n’a pas
montré non plus de résultats probants, en compa-
raison de l’association placebo + FOLFOX6 en
première ligne dans l’étude de phase II randomisée
RESPECT présentée à l’ESMO (8). Cette étude, qui
a inclus 198 patients, n’a montré aucun bénéfice
du sorafénib pour la survie ou la RO ; elle était en
revanche associée à une toxicité plus importante,
qui a conduit à son arrêt chez 32 % des patients et
à une réduction significative de la dose-intensité du
5-FU et de l’oxaliplatine. Le sorafénib doit-il pour
autant être complètement écarté du traitement du
CCRm ? La question reste ouverte au vu des résul-
tats de l’étude française de phase II NEXIRI, qui a
rapporté, chez 52 patients lourdement prétraités
(66 % avaient reçu au moins 3 lignes de CT) et à
KRAS muté, un taux de contrôle de la maladie de
65 % et une SSP de 3,5 mois avec l’association sora-
fénib + irinotécan (9). Le sorafénib pourrait donc
avoir un intérêt en situation de chimiorésistance
dans ce sous-groupe de patients à KRAS muté.
Une étude de phase II randomisée à 3 bras (NEXIRI 2)
va prochainement comparer cette association
à l’irino técan ou au sorafénib en mono thérapie.
Dans l’immédiat, cette molécule n’a toutefois pas
l’AMM dans le CCRm.
Après les résultats très décevants de tous les
ITK testés jusqu’à présent dans le CCRm, le seul
antiangiogénique à tirer son épingle du jeu est le
VEGF-trap, ou aflibercept, qui a montré des résultats
très prometteurs dans l’étude VELOUR, rapportée
pour la première fois au 14th World Congress on
Gastrointestinal Cancer (WCGC) de Barcelone (10)
puis au congrès de l’ESMO (11). Cet inhibiteur de
l’angiogenèse ne correspond ni à un anticorps ni à un
ITK mais à une protéine de fusion construite à partir
de parties du domaine extracellulaire des VEGFR-1 et
VEGFR-2 et d’un fragment Fc d’IgG1 humaine, ce qui
lui permet de cibler toutes les isoformes du VEGF-A,
du VEGF-B et du Placenta Growth Factor (PIGF).
L’étude VELOUR est une étude internationale de
phase III qui a randomisé 1 226 patients ayant
un CCRm prétraité par une CT à base d’oxalipla-
tine (dont environ 30 % avaient reçu du bévaci-
zumab) pour recevoir soit FOLFIRI + aflibercept
(4 mg/ kg) [n = 612] soit FOLFIRI + placebo (n = 614).
Les résultats montrent une amélioration significative
de la SG (critère principal) et de la SSP dans le bras
aflibercept (figure 2). Le taux de réponse était égale-
ment meilleur dans le bras aflibercept (19,8 versus
11,1 % ; p = 0,0001). Une analyse de sous-groupes
selon les critères de stratification établis initialement
(PS 0 versus 1 versus 2 et traitement antérieur par
bévacizumab ou non) et selon d’autres paramètres
cliniques et tumoraux a été réalisée. Cette analyse
qui comporte un test d’interaction ne laisse pas appa-
raître de différence significative selon que les patients
ont ou non été traités antérieurement par bévaci-
zumab. Chez les 373 patients prétraités par béva-
cizumab, la SSP médiane était de 6,7 mois dans le
bras aflibercept versus 3,9 mois dans le bras placebo

40 | La Lettre du Cancérologue • Vol. XXI - n° 1 - janvier 2012
Cancers digestifs
RÉTROSPECTIVE 2011
(HR = 0,66 ; IC95 : 0,51-0,85) et la médiane de SG de
12,5 versus 11,7 mois (HR = 0,86 ; IC95 : 0,67-1,10).
L’effet du traitement était plus prononcé chez les
patients présentant des métastases hépatiques
isolées (HR = 0,64 pour la SG, test d’interaction :
p = 0,09 ; HR = 0,54 pour la SSP, test d’interaction :
p = 0,008). L’association FOLFIRI + aflibercept a
été liée à plus de toxicités de grades 3-4 (diarrhée :
19,3 versus 7,8 % ; neutropénie : 36,7 versus 29,5 % ;
asthénie : 16,9 versus 10,6 % ; mucite : 13,7 versus
5 %) et d’effets indésirables spécifiques de l’action
anti-VEGF (hypertension artérielle : 19,3 versus
1,5 % ; hémorragie : 2,9 versus 1,7 % ; événements
thromboemboliques artériels : 1,8 versus 0,5 %).
Toutefois, l’incidence de ces derniers était compa-
rable, que les patients aient été prétraités par béva-
cizumab ou non.
Cette étude montre donc pour la première fois
l’efficacité d’un antiangiogénique autre que le béva-
cizumab en deuxième ligne du CCRm, avec une toxi-
cité qui reste acceptable. L’aflibercept devrait donc
probablement rejoindre prochainement l’arsenal
thérapeutique du CCRm chez les patients prétraités
par oxaliplatine.
◆Facteurs prédictifs de la réponse
aux anti-EGFR : au-delà des mutations
des codons 12 et 13 de KRAS…
Une étude publiée dans le Journal of the American
Medical Association l’année dernière (12) suggérait
que les mutations G13D avaient, d’une part, une
valeur pronostique péjorative et qu’elles seraient,
d’autre part, “sensibles” ou, en tout cas, moins résis-
tantes aux anti-EGFR que les autres types de muta-
tions de KRAS chez des patients chimiorésistants.
À l’ASCO®, cette année, ont été présentés par la
même équipe les résultats d’une analyse poolée des
essais de première ligne CRYSTAL et OPUS allant
dans le même sens (13), avec un taux de réponse
(40 versus 22 % ; p = 0,07), une SSP (7,4 versus
6 mois ; p = 0,1) et une SG (15,4 versus 14,7 mois ;
p = 0,37) améliorés par l’ajout du cétuximab chez
les patients avec une mutation G13D. Toutefois, les
différences n’étaient pas significatives sur ce petit
effectif de patients avec une mutation G13D (n = 83)
en raison de la faible fréquence de cette mutation
(20 % des mutations de KRAS). De plus, des résultats
contraires ont été présentés au congrès de l’ESMO à
partir d’une analyse poolée des 3 essais randomisés
évaluant le panitumumab en première, deuxième et
troisième ligne montrant l’absence d’impact pronos-
tique de ces mutations G13D et un effet délétère du
panitumumab en association avec le FOLFOX en leur
présence (14). L’ensemble de ces données ne permet
donc pas de conclure, et les mutations G13D, comme
les autres mutations des codons 12 et 13 de KRAS,
doivent donc, à l’heure actuelle, faire renoncer à un
traitement par anticorps anti-EGFR.
Cancer colique : traitement adjuvant
Les données actualisées des essais C-08 du National
Surgical Adjuvant Breast and Bowel Project (NSABP)
[15] et AVANT (16) confirment les résultats négatifs
de l’ajout du bévacizumab pendant 1 an à une CT
adjuvante par FOLFOX.
La publication de l’étude XELOXA est venue
confirmer la place du XELOX en situation adju-
vante dans les cancers coliques de stade III (17).
Cette étude randomisée de phase III menée chez
1 886 patients a comparé un schéma XELOX à une
association 5-FU + acide folinique (LV5FU) selon le
schéma Mayo Clinic ou Roswell Park. La survie sans
maladie (SSM) était significativement allongée dans
le bras XELOX, que ce soit à 3 (70,9 versus 66,5 %),
4 ou 5 ans (66 versus 59,8 % ; HR = 0,80 ; IC95 : 0,69-
0,93 ; p = 0,045). La survie sans récidive (SSR) était
également significativement allongée dans le bras
XELOX (HR = 0,78 ; IC
95
: 0,67-0,92). Quant à la SG,
bien que supérieure dans le bras XELOX (77,6 versus
74,2 %), elle n’était pas significativement différente
entre les 2 bras après un suivi médian de 57 mois.
Les résultats de cette étude font donc du XELOX
une alternative au FOLFOX en situation adjuvante.
Des résultats actualisés de l’essai NSABP C-07,
rapportant les données de SG mais aussi les résul-
tats d’analyses de sous-groupes, tenant compte
notamment du stade tumoral (II versus III) et de
l’âge des patients (plus ou moins de 70 ans), ont été
publiés (18). Cet essai a comparé, chez 2 409 patients
opérés d’un cancer colique de stade II (29 %) ou III
(71 %), une CT adjuvante par 5-FU + acide folinique
à 5-FU + acide folinique + oxaliplatine (FLOX).
Après un suivi médian de 8 ans, le bénéfice en SSM
persiste de manière significative dans le bras FLOX
(tableau IV, p. 41). En revanche, bien que meilleure,
la SG n’était pas significativement différente entre
les 2 bras. L’analyse de sous-groupes et les tests
d’interaction font clairement apparaître l’absence
de bénéfice de l’oxaliplatine chez les patients de plus
de 70 ans. Ces résultats, couplés à ceux de l’analyse
poolée du groupe ACCENT (Adjuvant Colon Cancer
Endpoints) [19], qui vont dans le même sens, doivent
donc nous rendre vigilants sur l’indication de l’oxali-
platine en situation adjuvante chez les patients de
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%