Cancers digestifs Digestive cancers Cancers colorectaux

Figure 1. Survie sans récidive selon le statut mutationnel de PIK3CA et la prise d’aspirine (d’après Church D et al.,
abstr. 2161 actualisé).
80 80
100 100
60 60
40 40
20 20
00
00
681
111
90
14
Patients à risque (n) Patients à risque (n)
11
649
103
82
14
22
562
90
69
13
PIK3CA sauvage PIK3CA muté
p = 0,71
HR (analyse multivariée) = 0,94 ;
IC95 : 0,59-1,49 ; p = 0,786
p = 0,036
HR (analyse multivariée) = 0,11 ;
IC95 : 0,001-0,83 ; p = 0,027
Aspirine Aspirine
Pas d’aspirine Pas d’aspirine
33
491
78
58
13
Années Années
44
409
62
47
10
55
233
33
29
6
Survie sans récidive (%)
Survie sans récidive (%)
444 | La Lettre du Cancérologue • Vol. XXII - n° 11 - décembre 2013
Cancers digestifs
Digestive cancers
A. Lièvre*, L. Dahan**, D. Smith***, E. François****
* Institut Curie, Saint-Cloud.
** Service d’oncologie digestive et
d’hépato-gastroentérologie, hôpital
de la Timone, Marseille.
*** Unité d’oncologie, CHU de
Bordeaux.
**** Centre Antoine-Lacassagne,
Nice.
Cancers colorectaux
A. Lièvre, L. Dahan, D. Smith
Cancers du côlon
◆Adjuvant
Mutation de PIK3CA : un marqueur prédictif du
bénéfi ce de l’aspirine en adjuvant ?
D’après Church D et al., abstr. 2161
Des données récentes suggèrent un bénéfi ce de
l’aspi rine en traitement adjuvant du cancer colorectal
(CCR) chez les patients dont la tumeur présente une
mutation de PIK3CA (1). Les auteurs ont cherché ici
à vérifi er cette hypothèse par une analyse rétro-
spective de 896 patients inclus dans l’étude VICTOR
qui randomisait 2 424 patients après résection
chirurgicale et CT adjuvante d’un CCR de stade II
ou III pour recevoir du rofécoxib (inhibiteur de COX2)
ou un placebo. Les patients inclus pouvaient ou non
continuer un traitement par aspirine à faible dose
(moins de 100 mg/j). Cette étude fut interrompue
prématurément du fait de la toxicité cardiovasculaire
du rofécoxib. Au total, 104 patients présentaient
une mutation de PIK3CA, dont 14 (13,5 %) avaient
reçu de l’aspirine.
Aucun impact du rofécoxib n’était observé selon le
statut mutationnel de PIK3CA. En revanche, la survie
sans récidive était fortement améliorée en présence
d’une mutation de PIK3CA chez les patients traités
par aspirine : aucune récidive à 3 ans n’a été observée
chez les 14 patients traités par aspirine, versus 30 chez
les 90 patients n’ayant pas reçu d’aspi rine (fi gure 1).
Une tendance non signifi cative en faveur d’un béné-
fi ce de l’aspirine en SG était également observée chez
les patients dont la tumeur était mutée pour PIK3CA
(HR = 0,29 ; IC95 : 0,04-2,33 ; p = 0,245).
Malgré les réserves liées au caractère observationnel
de cette étude et à l’absence de randomisation de
l’aspirine, ces résultats, qui viennent d’être publiés sur
le site Internet du Journal Of Clinical Oncology (2),
corroborent ceux déjà publiés et suggèrent que les
mutations de PIK3CA pourraient être prédictives d’un
bénéfi ce majeur de l’aspirine en situation adjuvante.
A. Lièvre
E. François
Actualités
au 38e ESMO

La Lettre du Cancérologue • Vol. XXII - n° 11 - décembre 2013 | 445
Points forts
»Mutations de PIK3CA : un marqueur de bénéfice de l’aspirine en traitement adjuvant des cancers coliques.
»
Absence d’intérêt de l’oxaliplatine associée à la radiothérapie néo-adjuvante des cancers du rectum localement
avancés (essai PETACC-6).
»
Meilleure SG avec FOLFIRI-cétuximab comparé au FOLFIRI-bévacizumab en 1
re
ligne des CCRm chez les patients
RAS sauvage (essai FIRE-3).
»
Équivalence du cétuximab et du panitumumab en monothérapie dans les CCRm chimiorésistants (essai ASPECCT).
»
Confirmation de l’action antiproliférative des analogues de la somatostatine dans les TNE pancréatiques et
extrapancréatiques de grades 1 et 2 avec Ki-67 < 10 %.
»
La mortalité postopératoire dans les cancers du tractus digestif supérieur est liée au volume opératoire du
centre et à l’organisation sanitaire du pays.
»Commencer vite la chimiothérapie en cas de cancer du pancréas évolué permet d’améliorer la survie.
Mots-clés
Cancer colorectal
Mutation
PIK3CA
RAS
Analogues
delasomatostatine
Tumeurs
neuroendocrines
Cancers
del’œsophage
Highlights
»
PIK3CA mutations : a predic-
tive marker of benefi t of aspirin
in adjuvant treatment of colon
cancer.
»
Lack of benefi t of oxaliplatin
in association with neoadjuvant
radiotherapy in locally advanced
rectal cancers (PETACC-6 trial).
»
Increased overall survival
with FOLFIRI-cetuximab
compared to FOLFIRI-bevaci-
zumab in fi rst line treatment of
metastatic colorectal cancer in
wild-type RAS patients (FIRE-3
trial).
»
Equivalence of cetuximab and
panitumumab monotherapy in
metastatic chemoresistant
colorectal cancer (ASPECCT
trial).
»
Confi rmation of the antipro-
liferative action of somatostatin
analogues in pancreatic and
extrapancreatic NETs grade 1
and 2 with Ki-67<10%.
»
The post-operative mortality
in the cancers of the upper
digestive tract is related to the
surgical volume of the center
and to the health organization.
»
A fast starting up chemo-
therapy in advanced pancreatic
cancer improves overall survival.
Keywords
Colorectal cancer
Mutation
PIK3CA
RAS
Somatostatin analogues
Neuroendocrine tumors
Esophageal cancer
Chimiothérapie adjuvante des cancers coliques :
rien ne sert de prolonger !
D’après Sadahiro S et al. et al., abstr. 2155
L’étude japonaise de phase III JFMC33-0502 visait à
évaluer si un traitement par uracile-tégafur + acide
folinique pendant 18 mois était supérieur au même
traitement administré pendant 6 mois. Au total,
1 017 patients ayant eu une résection chirurgicale
d’un cancer de stade IIb (13 %) ou III (87 %) ont
été randomisés. Les résultats ne montrent pas de
différence entre les 2 bras en termes de survie sans
récidive, objectif principal de l’étude (taux de survie
sans maladie de respectivement 73 et 74 % à 3 ans
et de 69 % dans les 2 bras à 5 ans).
Il n’y a donc clairement pas d’indication à un traite-
ment adjuvant prolongé dans les cancers coliques…
et la principale question actuellement, posée par
l’essai IDEA en cours, est au contraire de savoir si
une réduction de la durée du traitement adjuvant
(FOLFOX/XELOX pendant 3 mois) permet ou non
d’obtenir les mêmes résultats que le traitement
standard pendant 6 mois.
Essai CEA Watch : intérêt de l’ACE intensifi é dans
la surveillance des cancers colorectaux
D’après Verberne C et al., abstr. 2151
Cet essai randomisé a comparé une surveillance
intensifi ée par dosage de l’ACE toutes les 8 semaines
à une surveillance classique selon les recommanda-
tions hollandaises chez 3 223 patients opérés d’un
CCR de stade I à III, inclus dans 11 centres hollandais.
Un scanner était réalisé en cas d’augmentation de
l’ACE de plus de 20 %.
Au total, 243 récidives (7,5 %) ont été mises en
évidence. Il y a eu signifi cativement plus de récidives
diagnostiquées (57 versus 43 % ; p = 0,015) et plus
d’interventions chirurgicales curatives de la récidive
(42 versus 30 % ; p = 0,027) dans le bras intensifi é.
Au total l’ACE, déjà largement utilisé dans la
surveillance des CCR, augmente le taux de récidives
diagnostiquées et curables dans cette étude. On
attend cependant de savoir si cette stratégie aura
un impact sur la SG des patients.
Les résultats de l’essai PRODIGE 13 sont en attente
et permettront sûrement de répondre défi nitivement
à la question de l’apport de l’ACE dans la surveillance
des CCR.
Mutations de KRAS :
aussi un marqueur pronostique !
D’après Yoon HH et al., abstr. 2160
Les mutations de KRAS sont surtout connues pour
être des marqueurs prédictifs de résistance au
cétuximab. Dans cette étude, les auteurs ont analysé
la valeur pronostique des mutations des codons 12
et 13 de KRAS chez 2 165 patients opérés d’un cancer
colique de stade III, traités par FOLFOX avec ou
sans cétuximab dans le cadre de l’essai de phase III
NCCTG N0147 qui, rappelons-le, était négatif (3).
Seules les tumeurs sans mutation de BRAF ont été
considérées ici pour s’affranchir de la valeur pronos-
tique péjorative bien établie de ces mutations.
Après avoir vérifi é l’absence de valeur prédictive
des mutations de KRAS et de BRAF sur le béné-
fi ce du cétuximab, l’étude montre que les patients
ayant une tumeur qui présentait une mutation du
codon 12 (24,4 %) ou du codon 13 (7,3 %) de KRAS
avaient une survie sans maladie et une survie sans
récidive signifi cativement moins bonnes que les
patients KRAS sauvage (fi gure 2, p. 446). Cette
valeur pronostique des mutations de KRAS était
maintenue en analyse multivariée après ajustement,
notamment sur le stade T, le nombre de ganglions
positifs et examinés, le statut MSI et le traitement
reçu (HR =1,44, IC95 : 1,20-1,73, p = 0,0001 pour les
mutations du codon 12 ; HR = 1,34, IC
95
: 1,01-1,80,
p = 0,046 pour les mutations du codon 13).
Cette étude rejoint donc les résultats de l’étude
anglo-saxonne RASCAL (4) qui, déjà en 1998, avait
montré une valeur pronostique des mutations de
KRAS restant néanmoins confi née aux mutations
G12V. La nouveauté apportée ici est que toutes
les mutations du codon 12, mais aussi celles du
codon 13, sont de mauvais pronostic. L’utilité de
cette information reste toutefois à démontrer en
pratique clinique.
◆Métastatique
FIRE-3 : les résultats chez les patients RAS
sauvages creusent l’écart en survie globale en
faveur du cétuximab !
D’après Stintzing S et al., abstr. LBA17
L’étude FIRE-3, présentée cette année au congrès
américain en oncologie clinique, comparait pour
la première fois le cétuximab et le bévacizumab en

Figure 2. Impact pronostique des mutations de KRAS (d’après Yoon HH et al., abstr. 2160 actualisé).
0,8 80
1,0 100
0,6 60
0,4 40
0,2 20
00
0010 1020 20
KRAS sauvage (n = 1 479)
Codon 12 (n = 528)
Codon 13 (n = 158)
KRAS sauvage (n = 1 479)
Codon 12 (n = 528)
Codon 13 (n = 158)
p = 0,0032
(versus KRAS sauvage) p = 0,0067
(versus KRAS sauvage)
p < 0,0001
(versus KRAS sauvage) p < 0,0001
(versus KRAS sauvage)
Survie sans progression Temps jusqu’à récidive
30 30
Mois depuis la randomisation Mois depuis la randomisation
40 4050 5060 60
Probabilité de SSP
SSR (%)
446 | La Lettre du Cancérologue • Vol. XXII - n° 11 - décembre 2013
Cancers digestifs
première ligne métastatique du CCR. Initialement
ouverte à tous les patients, l’étude a été rapidement
amendée pour n’inclure que ceux ayant une tumeur
KRAS exon 2 sauvage à partir de 2008, et a rando-
misé 592 patients KRAS sauvage pour recevoir du
FOLFIRI + cétuximab ou du FOLFIRI + bévacizumab.
Dans cette population, alors que l’objectif principal
de taux de réponse n’était pas atteint (62 versus
58 %), il existait une différence significative en
termes de SG en faveur du bras cétuximab (médiane
de 28,7 versus 25 mois ; p = 0,017) sans amélioration
de la SSP.
Les résultats présentés au congrès de l’ESMO
rapportent les analyses des patients selon le statut
mutationnel des exons 3 et 4 de KRAS et de NRAS,
la présence de ces “nouvelles” mutations ayant
été récemment démontrée prédictive de résis-
tance au panitumumab dans l’étude PRIME (5).
Sur les 488 patients KRAS exon 2 sauvage initiale-
ment analysés en intention de traiter, 407 ont été
évaluables pour l’ensemble des mutations de RAS ;
parmi eux, 342 étaient RAS sauvage et 65 avaient
une “nouvelle” mutation de RAS.
Chez les patients RAS sauvage (exons 2, 3 et 4 de
KRAS et de NRAS), il n’y avait toujours pas de diffé-
rence signifi cative en termes de RO, ni en termes de
SSP (tableau I). En revanche, la différence en termes
de SG en faveur du bras cétuximab était encore plus
importante que celle observée chez les patients KRAS
sauvage, avec une survie médiane de 33,1 mois dans
le bras cétuximab, contre 25,6 mois dans le bras
bévacizumab (fi gure 3). L’accès aux traitements
de deuxième ligne était similaire dans les 2 bras.
Chez les patients RAS muté, il était observé une
tendance non signifi cative à une meilleure RO et à
une meilleure SSP dans le bras bévacizumab.
Tableau I. Étude FIRE-3 : résultats selon le statut RAS (KRAS/NRAS exons 2, 3, 4) [d’après Stintzing S et al., abstr. LBA17
actualisé].
FOLFIRI/cétuximab FOLFIRI/bévacizumab
RAS exon 2 sauvage (n=592)
RO (%)
SSP médiane (mois)
SG médiane (mois)
62
10
28,7
58
10,3
25
HR=1,18; IC95: 0,88-1,26; p=0,183
HR=1,06; IC95: 0,74-1,17; p=0,547
HR=0,77; IC95: 0,62-0,96; p = 0,017
RAS sauvage (n=342)
RO (%)
SSP médiane (mois)
SG médiane (mois)
65,5
10,4
33,1
59,6
10,2
25,6
HR=1,28; IC95: 0,83-1,99; p=0,32
HR=0,93; IC95: 0,74-1,17; p=0,54
HR=0,70; IC95: 0,53-0,92; p = 0,011
RAS muté (n=178)
RO (%)
SSP médiane (mois)
SG médiane (mois)
38
7,5
20,3
51,2
10,1
20,6
HR=0,59; IC95: 0,32-1,06; p=0,097
HR=1,31; IC95: 0,98-1,78; p=0,085
HR=1,09; IC95: 0,78-1,52; p=0,6
Actualités
au 38e ESMO

Figure 3. Étude FIRE-3 : survie globale (RAS sauvage) [d’après Stintzing S et al., abstr. LBA17
actualisé].
75
100
50
25
0
0
171
171
12
128
127
24
71
68
Événements
n/N (%)
91/171
(53,2)
110/171
(64,3)
SG médiane
(mois)
33,1
25,6
IC95
24,5-39,4
22,7-28,6
Δ = 7,5 mois
HR = 0,70 ; IC95 : 0,53-0,92
p (log-rank) = 0,011
FOLFIRI + cétuximab
FOLFIRI + bévacizumab
36
39
26
Patients à risque (n) Mois
48
20
9
60
6
1
72
Probabilité de survie (%)
La Lettre du Cancérologue • Vol. XXII - n° 11 - décembre 2013 | 447
Ces résultats méritent confi rmation (on attend avec
impatience les résultats de l’étude CALGB 80405
qui évalue FOLFOX/FOLFIRI + cétuximab ou
bévacizumab). Cependant, mis en parallèle avec
l’étude de phase II PEAK, présentée par M. Karthaus
(abstr. 2262), il semble que l’on dispose là d’un meil-
leur ciblage des patients (les “RAS sauvage”) pouvant
tirer le plus grand bénéfi ce d’un anticorps anti-EGFR
en première ligne métastatique.
Essai OLIVIA : bévacizumab + FOLFOX ou
FOLFOXIRI chez les patients avec métastases
isolées initialement non résécables
D’après Bridgewater J et al., abstr. 2159
Cet essai de phase II randomisé a inclus en première
ligne 80 patients atteints d’un CCR avec méta-
stases hépatiques (MH) isolées initialement non
résécables. Les patients ont reçu du bévacizumab
associé au FOLFOXIRI (n = 41) ou au FOLFOX6m
(n = 39), l’essai ayant pour objectif principal le taux
de résection secondaire.
Au fi nal, respectivement 25 et 19 patients ont été
opérés. Il y a eu signifi cativement plus de résec-
tions R0 dans le bras FOLFOXIRI + bévacizumab
(48,8 versus 23,1 % ; p = 0,017) et une tendance
non significative à un meilleur taux de réponse
(80,5 versus 61,5 % ; p = 0,61). Par ailleurs, la SSP
était signifi cativement améliorée avec la quadri-
thérapie par rapport au bras FOLFOX6m + bévaci-
zumab (18,8 versus 12 mois ; p = 0,0012), avec un
écart majoré chez les patients ayant eu une résection
R0/R1 (21 versus 13,6 mois). Cette différence n’était
plus retrouvée chez les patients avec résection R2.
Cette quadrithérapie permet donc d’obtenir, dans
une population très sélectionnée, des taux de résé-
cabilité et de SSP très élevés, au prix bien sûr d’une
toxicité de grade 3-4 plus importante (neutropénie :
47,5 versus 35,1 % ; diarrhée : 27,5 versus 13,1 % ;
nausée : 7,5 versus 2,1 %).
Hépatectomie en 2 temps pour métastases
hépatiques initialement non résécables : résultats
d’une étude prospective française
D’après Rivoire M et al., abstr. 2175
Cette étude de phase II française est la première
étude prospective à rapporter les résultats de l’hépa-
tectomie en 2 temps pour MH de CCR. Cette étude
a inclus, dans 8 centres, 54 patients ayant des MH
initialement non résécables. La plupart avaient
des métastases synchrones (93 %) et tous avaient
reçu une CT d’induction − soit une bichimiothérapie
(FOLFOX ou FOLFIRI), soit une trichimiothérapie de
type FOLFIRINOX (15 %) −, associée ou non à une
thérapie ciblée (80 %). Parmi les 54 patients inclus,
41 ont pu avoir les 2 interventions chirurgicales ; la
principale cause de non-réalisation de la deuxième
hépatectomie était la progression. La première était
une hépatectomie mineure combinée ou non à la
résection de la tumeur primitive (57 %), une embo-
lisation portale (43 %) ou la résection de la tumeur
extrahépatique (20 %), avec un taux de complica-
tions de 44 % (grade 3-4 : 8 %). L’intervalle entre
les 2 hépatectomies était en moyenne de 1,9 mois.
La seconde était une hépatectomie majeure dans
71 % des cas, avec un taux de complications de 32 %
(grade 3-4 : 10 %).
Cette stratégie agressive a été “payante” car dans
cette série de patients, bien sûr, très sélectionnés,
les taux de SG et de survie sans récidive à 3 ans
étaient respectivement de 64 et 19 %. Le pronostic
des patients ayant eu une résection R0/R1 était,
sans surprise, meilleur que celui de ceux ayant eu
une résection R2 (survie à 3 ans de 78 versus 30 %).
Essai ASPECCT : panitumumab versus cétuximab
en troisième ligne, du pareil au même !
D’après Price T et al., abstr. LBA18
Le cétuximab a démontré qu’il était supérieur en
termes de SSP et de SG par rapport aux soins de
confort en troisième ligne de traitement du CCR
métastatique (CCRm) KRAS sauvage (6). Dans
la même situation, le panitumumab n’a, quant à
lui, montré qu’un bénéfi ce en SSP mais pas en SG,
Actualités
au 38e ESMO

448 | La Lettre du Cancérologue • Vol. XXII - n° 11 - décembre 2013
Cancers digestifs
très probablement en raison du fort taux (75 %) de
cross over dans l’étude de R.G. Amado et al. (7).
ASPECCT est une étude de phase III randomisée
qui avait pour objectif principal de démontrer la
non-infériorité du panitumumab (n = 499) par
rapport au cétuximab (n = 500) en termes de SG
chez des patients ayant un CCRm chimiorésistant
(échec du 5-FU, de l’oxaliplatine et de l’irinotécan)
KRAS sauvage. Les résultats montrent une équiva-
lence des 2 anticorps anti-EGFR, aussi bien en SG
(HR = 0,97 ; IC95 : 0,84-1,11) qu’en SSP (HR = 1,00 ;
IC95 : 0,882-1,138) et en taux de réponse (22 versus
19,8 %). La tolérance était sensiblement la même
dans les 2 bras, avec cependant moins de réactions
allergiques dans le bras panitumumab (2,8 versus
12,5 %).
Cette étude démontre donc que le cétuximab et
le panitumumab sont aussi effi caces en troisième
ligne du CCRm. Cette équivalence reste désormais
à démontrer en première et en deuxième lignes…
Cancers du rectum
◆Chirurgie
Les nouvelles techniques opératoires confortent
leurs résultats
Van der Pas M et al., abstr. 2150 ; Van Leersum N
et al., abstr. 2152
Les résultats à court terme de l’essai COLOR II ont
été présentés. Cet essai randomisé international
de non-infériorité de la laparoscopie par rapport à
la chirurgie ouverte dans le cancer du rectum avait
pour objectif principal le taux de récidive locale à
3 ans. Selon une randomisation 2:1 (laparoscopie/
laparotomie), 1 044 patients ayant un cancer du
rectum situé à moins de 15 cm de la marge anale
ont été inclus. Soixante pour cent avaient été préala-
blement irradiés (30 % par RCT). Le taux de conver-
sion était de 16 %, statistiquement majoré chez les
patients ayant un IMC supérieur à 25 (OR = 2,7 [IC95 :
1,7-3,7]), plus de à 65 ans (OR = 1,9 [IC95 : 1,2-3,0])
et un pôle inférieur de la tumeur au-dessus de 5 cm.
Les avantages connus de la laparoscopie sont
confi rmés malgré un temps opératoire supérieur
de 52 minutes en médiane : il y avait signifi cative-
ment moins de pertes sanguines (200 versus 400 ml ;
p < 0,001), une réduction de la durée d’hospitalisa-
tion (8 versus 9 j ; p = 0,036), une reprise du transit
et de l’ingestion de liquides également plus rapides.
Reste à savoir si, à plus long terme, les séquelles
fonctionnelles et les résultats oncologiques seront
infl uencés par la procédure chirurgicale.
Une autre étude, menée en Hollande, a montré que
le risque d’envahissement des marges d’exérèse après
amputation abdominopérinéale a considérablement
diminué et se rapproche des résultats de la résection
antérieure, avec toujours un risque plus important
pour les tumeurs cT4 et/ou celles situées à moins
de 3 cm de la marge anale.
◆Néo-adjuvant et adjuvant
PETACC-6 ou la mort annoncée de l’oxaliplatine
en néo-adjuvant
D’après Schmoll HJ et al., abstr. 2155
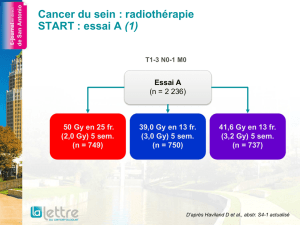
L’étude PETACC-6 comparait une RCT préopératoire
suivie d’une CT postopératoire à base de capécita-
bine (bras CAP) à la même séquence combinant
la capécitabine à l’oxaliplatine (bras CAPOX) dans
les cancers du rectum localement avancés, avec
pour objectif principal la SSP à 3 ans. Cet essai est
le cinquième évaluant l’intérêt de l’adjonction de
l’oxaliplatine à la RCT préopératoire dans le cancer
du rectum, et le deuxième à évaluer le FOLFOX en
adjuvant dans cette situation.
Les résultats préliminaires présentés lors du congrès
concernent les données relatives au contrôle local,
qui est un des objectifs secondaires de l’étude
avec la SG et la toxicité. Entre novembre 2008
et septembre 2011, 1 094 patients ont été inclus
(547 dans chaque bras) dans 181 centres français.
Dans les bras CAP et CAPOX, respectivement 97,8 et
92,5 % des patients avaient reçu la dose complète
de RT, et 7,3 et 21,8 % avaient reçu moins de 90 %
de la dose de capécitabine. Le CAPOX était globale-
ment plus toxique (37,6 % de toxicités de grade 3-4
versus 15,2 %) et associé à un taux de résection
R0 plus bas sans amélioration du taux de réponse
complète pathologique ni du taux de conserva-
tion sphinctérienne similaire (tableau II). Le taux
Tableau II. Étude PETACC-6 : résultats (d’après Schmoll HJ et al., abstr. 2155A actualisé).
Capécitabine +
radiothérapie
CAPOX +
radiothérapie
p
Patients randomisés (ITT)
Opérés (%)
Résection (%)
Résection R0 (%)
Réponse complète pathologique (%)
Préservation sphinctérienne (%)
n = 547
95,8
95,6
92,3
11,5
69,3
n = 547
90,9
90,7
87,2
13
65,4
< 0,01
0,46
0,15
Patients ayant subi une résection
Résection R0 (%)
pRC (%)
Préservation sphinctérienne (%)
n = 522
96,6
12,1
72,4
n = 495
96,2
14,3
72,1
NS
Actualités
au 38e ESMO
 6
6
 7
7
 8
8
 9
9
1
/
9
100%