Merck annonce la première présentation des données sur l

Communiqué de presse
_____________________________________________________________________________________
Relations avec les médias :
Annick Robinson
Merck
438-837-2550
Stephanie Lyttle
Le Cabinet de relations publiques NATIONAL
514-843-2365
Relations avec les investisseurs :
Justin Holko
Merck
+1 908-423-5088
Merck annonce la première présentation des données sur
l’utilisation expérimentale du pembrolizumab chez des patients atteints d’un
cancer de l’estomac ou d’un cancer de la vessie de stade avancé au congrès 2014 de
l’ESMO
L’administration du pembrolizumab en monothérapie a été associée à un taux de réponse
global de 31 % chez les patients atteints d’un cancer de l’estomac de stade avancé exprimant le
PD-L1 et un taux de réponse global de 24 % chez les patients atteints d’un cancer de la vessie
(tumeur urothéliale) de stade avancé exprimant le PD-L1.
On prévoit commencer une étude de phase 3 chez des patients atteints d’un cancer de la
vessie de stade avancé d’ici la fin de 2014
Une étude de phase 2 sur le cancer de l’estomac de stade avancé commencera au cours du
premier trimestre de 2015
Kirkland (Québec), le 29 septembre, 2014 – Merck, connue sous le nom de MSD à
l’extérieur du Canada et des États-Unis, a annoncé aujourd'hui la première présentation des
données sur l’utilisation expérimentale du pembrolizumab dans le traitement de deux types de
cancers, soit le cancer de l’estomac de stade avancé et le cancer de la vessie de stade avancé,
lors du congrès 2014 de la European Society for Medical Oncology (ESMO), du 26 au
30 septembre 2014 à Madrid, en Espagne. Présent lors de la conférence, le Dr Normand Blais,
oncologue et hématologue au Centre hospitalier de l’Université de Montréal, a insisté sur
l’importance des données de recherche clinique comme celles-ci pour les Canadiens : « En
2014, le nombre de nouveaux cas de cancer est estimé à 191 0001. Les recherches cliniques
dans le domaine de l’immuno-oncologie, nouveau type de traitement novateur qui utilise le
système immunitaire du patient pour cibler le cancer, nourrissent l’espoir dans ce domaine. »

- 2 -
« Merck poursuit les étapes de mise au point du pembrolizumab dans le traitement de
divers types de tumeurs et évalue divers schémas de traitements », affirme la Dre Alise Reicin,
vice-présidente pour l’oncologie, Laboratoires de recherche de Merck. « Les signes de l’activité
antitumorale du pembrolizumab dans le traitement du cancer de l’estomac de stade avancé
sont encourageants. Nous sommes impatients de commencer l’étude de phase 2 pour mieux
comprendre le potentiel du pembrolizumab dans le traitement du cancer de l’estomac de stade
avancé. Comme indiqué précédemment, Merck commencera cette année une étude de phase 3
pour mieux comprendre le potentiel du pembrolizumab dans le traitement du cancer de la
vessie de stade avancé en raison de ces données. »
À propos des données présentées au congrès 2014 de l’ESMO sur l’utilisation
expérimentale du pembrolizumab chez les patients atteints d’un cancer de
l’estomac de stade avancé
Merck a annoncé aujourd'hui la première présentation des données sur l’utilisation
expérimentale du pembrolizumab (traitement anti-PD-1, pour programmed cell death-1 de
l’entreprise) chez des patients atteints d'un cancer de l’estomac de stade avancé exprimant le
PD-L1. Les premières données présentées révèlent que l’administration du pembrolizumab en
monothérapie est associée à un taux de réponse global (réponse confirmée ou non confirmée)
de 31 %, selon l’évaluation des chercheurs basée sur les critères RECIST 1.1 (n = 12/39 : IC à
95 %; 17-47). Des taux de réponse globale semblables ont été observés chez des patients
asiatiques (population chez qui l’incidence du cancer de l'estomac est élevée) et des patients
non asiatiques. Au moment de l’analyse, la durée de la réponse était de 8+ à 20+ semaines. En
tout, 11 des 12 patients qui avaient présenté une réponse ont poursuivi le traitement.
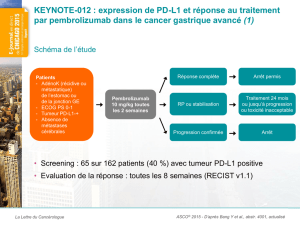
Ces données, sur une cohorte de l’étude KEYNOTE-012 de phase 1b qui est toujours en
cours, ont été présentées aujourd’hui dans le cadre d’une courte présentation orale tardive du
Dr Kei Muro (Aichi Cancer Center Hospital, à Nagoya, au Japon) lors du congrès de l’ESMO
(RÉSUMÉ nº LBA15). Des données sur l’évaluation de l’utilisation du pembrolizumab en
monothérapie dans le traitement de cinq types de tumeurs seront présentées au congrès 2014
de l’ESMO.

- 3 -
Résultats préliminaires sur l’utilisation expérimentale du pembrolizumab dans le
traitement du cancer de l’estomac de stade avancé
Les données ont été tirées de l’analyse d’une cohorte de l’étude de phase 1b
KEYNOTE-012 (toujours en cours), qui visait à évaluer l’administration du pembrolizumab en
monothérapie à raison de 10 mg/kg toutes les deux semaines chez des patients atteints d’un
cancer de l’estomac de stade avancé exprimant le PD-L1 (n = 39), tel que confirmé par un test
d’immunohistochimie exclusif de Merck, pour les études cliniques. Les tumeurs des patients
étaient classées comme exprimant le PD-L1 si au moins un pour cent des cellules tumorales
exprimaient le marqueur PD-L1 ou si un résultat positif était obtenu à la coloration des cellules
du stroma tumoral avec le même réactif. La méthode de sélection des patients visait à inclure
un nombre égal de patients asiatiques et non asiatiques. La majorité des patients avaient déjà
reçu un régime de traitement ou plus.
Activité antitumorale selon les critères d’évaluation RECIST 1.1 (Response Evaluation
Criteria in Solid Tumours)*
Total
n = 39
Non-
asiatiques
n = 20
Asiatiques
n = 19
Taux de réponse global, % (IC à 95 %)
31 (17-47)
30 (12-54)
31 (12-56)
Taux de maîtrise de la maladie, % (IC à
95 %)
43 (28-60)
35 (15-59)
52 (29-75)
Meilleure réponse globale, n (%)
• Réponse complète
0
0
0
• Réponse partielle
12 (31)
6 (30)
6 (32)
• Stabilité de la maladie
5 (13)
1 (5)
4 (21)
• Évolution de la maladie
21 (54)
12 (60)
9 (47)
• Aucune évaluation
1 (2)
1 (5)
0
* Date de l’analyse : le 6 août 2014
Un prototype d’essai pour l’évaluation du PD-L1 a révélé qu’il existe un lien préliminaire entre l’expression
du PD-L1 et le taux de réponse global (p = 0,071)
Dans le cadre de l’étude, une réduction du volume de la tumeur a été observée chez
41 % des patients dont l’évolution de la maladie était évaluable au moyen d’un examen de
tomodensitométrie après l'instauration du traitement, selon les critères d’évaluation RECIST 1,1.

- 4 -
Les événements indésirables étaient conformes aux données déjà rapportées sur
l’innocuité du pembrolizumab. Parmi les événements indésirables les plus courants liés au
traitement, selon l’évaluation faite par les chercheurs (survenus chez plus de 5 % des patients),
on compte l’hypothyroïdie (12,8 %) et la fatigue (12,8 %). Des événements indésirables liés au
traitement de grade 3 à 5 selon l’évaluation faite par les chercheurs ont été observés chez un
total de 3 patients : un cas de neuropathie périphérique du système sensitif (grade 3), un cas
d’hypoxie (grade 5) et un cas de pneumonite (grade 4). Aucune réaction à la perfusion n’a été
observée et aucun patient n’a abandonné le traitement au pembrolizumab en raison d’une
réaction liée au traitement. Un décès lié au traitement causé par une hypoxie a été signalé.
Présentation de résultats additionnels sur l’emploi du pembrolizumab dans le traitement
du cancer du poumon non à petites cellules (CPNPC) de stade avancé
Les derniers résultats de l’étude des cohortes de patients de l’étude KEYNOTE-001 de
phase 1b (toujours en cours) atteints d’un cancer du poumon non à petites cellules (CPNPC) de
stade avancé, préalablement traités ou non, ont également été présentés aujourd'hui (résumé
nº LBA43). Des données présentées dans le cadre d'une présentation orale tardive ont révélé
l’activité antitumorale du pembrolizumab (taux de réponse global) chez des patients atteints
d’un CPNPC de stade avancé préalablement traités ou non (n = 236). Le taux de réponse était
respectivement de 26 % et de 20 % dans ces deux groupes, peu importe la dose administrée et
le schéma de traitement, conformément à l’examen centralisé indépendant, en fonction des
critères RECIST 1.1. L’analyse selon la dose administrée (2 mg/kg toutes les 3 semaines,
10 mg/kg toutes les 3 semaines et 10 mg/kg toutes les 2 semaines) a révélé que le taux de
réponse global était comparable, peu importe le schéma thérapeutique (33 %, 21 % et 21 %,
respectivement).
À propos des données présentées au congrès 2014 de l’ESMO sur l’utilisation
expérimentale du pembrolizumab chez les patients atteints d’un cancer de la
vessie de stade avancé
Merck a également annoncé aujourd'hui la première présentation des données sur
l’utilisation expérimentale du pembrolizumab (traitement anti-PD-1 de l'entreprise) chez des
patients atteints d’une tumeur urothéliale de stade avancé exprimant le PD-L1, ou « cancer de
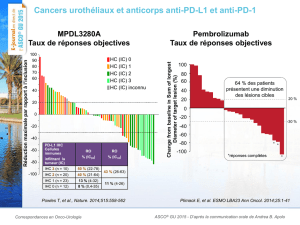
la vessie ». Les premières données présentées révèlent que l’administration du pembrolizumab
en monothérapie est associée à un taux de réponse global confirmée de 24 %, conformément à
l’examen centralisé, en fonction des critères RECIST 1.1 (n = 7/29 : IC à 95 %; 10,3-43,5), et à
un taux de réponse complète de 10 % (3/29). Au moment de l’analyse, la durée de la réponse
était de 16+ à 40+ semaines. En tout, 6 des 7 patients qui avaient présenté une réponse ont

- 5 -
poursuivi le traitement. Dans le cadre de cette étude, 64 % (61/95) des patients dont la réponse
pouvait être évaluée présentaient une tumeur exprimant le PD-L1.
Ces données, sur une cohorte de l’étude KEYNOTE-012 de phase 1b qui est toujours en
cours, ont été présentées aujourd'hui dans le cadre d’une courte présentation orale tardive de la
Dre Elizabeth R. Plimack (Fox Chase Cancer Center de Philadelphie) lors du congrès de
l’ESMO (RÉSUMÉ nº LBA23).
« Bien que les données soient limitées à l’heure actuelle, le taux de réponse, le taux de
réponse complète et la persistance de la réponse chez les patients atteints d’un cancer de la
vessie de stade avancé, sont encourageants », souligne la Dre Alise Reicin, vice-présidente
pour l’oncologie, Laboratoires de recherche de Merck.
Résultats préliminaires sur l’utilisation expérimentale du pembrolizumab dans le
traitement du cancer de la vessie de stade avancé
Les données ont été tirées de l’analyse d’une cohorte de l’étude de phase 1b
KEYNOTE-012 (toujours en cours), qui visait à évaluer l’administration du pembrolizumab en
monothérapie à raison de 10 mg/kg toutes les deux semaines chez des patients atteints d’un
cancer de la vessie de stade avancé, exprimant le PD-L1 (n = 29). Les tumeurs étaient
classées comme exprimant le PD-L1 si au moins un pour cent des cellules tumorales
exprimaient le marqueur PD-L1, tel que mesuré par le test d’immunohistochimie pour les études
cliniques exclusif de Merck, ou si un résultat positif était obtenu à la coloration des cellules du
stroma tumoral avec le même réactif. La majorité des patients avaient déjà reçu un régime de
traitement ou plus.
Activité antitumorale selon les critères d'évaluation RECIST 1.1*
Patients dont la réponse a pu être évaluée
(n = 29)
n
Pourcentage
IC à 95 %
Taux de réponse global
7
24,1
10,3 – 43,5
Meilleure réponse globale
• Réponse complète
3
10,3
2,2 – 27,4
• Réponse partielle
4
13,8
3,9 – 31,7
• Stabilité de la maladie
4
13,8
3,9 – 31,7
• Évolution de la maladie
14
48,3
29,4 – 67,5
• Aucune évaluation
4
13,8
3,9 – 31,7
* Date de l’analyse : le 6 août 2014
 6
6
 7
7
 8
8
 9
9
1
/
9
100%