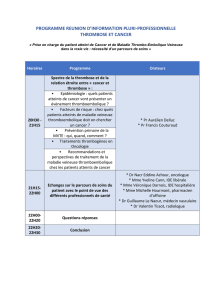
Thrombophilie constitutionnelle

Thrombophilie constitutionnelle (I)
Mutation du facteur V Leiden = résistance à la protéine C activée
La thrombophilie est un trouble caractérisé par une coagulabilité accrue du sang, tendant à favoriser
la survenue d’une thrombose.
Qu’est-ce que la coagulation ?
Notre système de coagulation est composé de divers éléments. Le sang contient certaines protéines
qui sont formées dans le foie et permettent au sang de coaguler. Il s’agit des facteurs de la
coagulation. En cas de lésion de l’organisme, ces facteurs interviennent et produisent de la fibrine.
La fibrine vient s’ajouter aux thrombocytes (plaquettes) du sang pour former un thrombus ou clou
hémostatique.
Le système de la coagulation doit être régulé car, sans cette régulation, il donnerait lieu, en
permanence, à la formation excessive de nombreux petits thrombus. Les facteurs de la coagulation
ont leurs inhibiteurs, qui limitent le processus de coagulation et peuvent cliver certains d’entre eux.
Une fois clivés par les facteurs anticoagulants, les facteurs de la coagulation ne peuvent plus former
de fibrine. Le système des facteurs de la coagulation et leurs inhibiteurs constituent un équilibre
délicat. Si les facteurs de la coagulation prédominent ou s’il y a déficit en inhibiteurs, il y a
déséquilibre et l’on assiste à une formation accrue de thrombus avec le risque qui en découle pour le
patient.
La constitution des facteurs de la coagulation peuvent se trouver modifiés de telle façon qu’ils ne
sont plus clivés par leurs inhibiteurs ou que le clivage ne s’effectue que lentement. C’est ce qui se
passe avec la mutation du facteur V Leiden.
Quelle est l’origine du nom Leiden ?
Ce type de thrombophilie a été décrit pour la première fois en 1994 à l’Université de Leiden aux

Pays-Bas.
Par quelles modifications cette mutation se traduit-elle ?
La mutation (substitution de protéine) concerne un facteur clé de la coagulation sanguine (facteur
V). La conséquence de cette mutation est qu’un facteur anticoagulant intrinsèque important
(protéine C activée ou PCA) ne peut cliver le facteur V que lentement, le site de clivage du facteur
V ayant changé. L’équilibre de la coagulation tend alors vers une coagulabilité nettement accrue du
sang, phénomène désigné par le terme d’hypercoagulabilité. Le facteur V est ainsi rendu résistant au
clivage par la protéine C activée. Le terme de « résistance à la protéine C activée » est utilisé pour
décrire cet état. La résistance à la protéine C activée est par conséquent presque entièrement due à
cette modification qualitative du facteur V qui est prédéterminée génétiquement. Si son résultat est
trop faible, le test de la résistance à la protéine C activée doit toujours être suivi d’une analyse de la
mutation du gène du facteur V par technique de biologie moléculaire. (figures 2 et 3.)

Qu’entend on par « prédéterminé génétiquement » ?
Chez l’homme, chaque noyau cellulaire compte 46 chromosomes. Ils portent l’information
génétique. Il existe 22 paires de chromosomes, la moitié de chaque paire provenant de la mère et
l’autre du père, plus deux chromosomes sexuels ou gonosomes qui déterminent le sexe (sexe
masculin : 1 chromosome X + 1 chromosome Y ; sexe féminin : 2 chromosomes X). (figure 4)

Le défaut est retrouvé au niveau de la paire de chromosomes n° 1. Comme tous les chromosomes
humains sont appariés, soit seul un chromosome de la paire n° 1 est touchée (porteur hétérozygote,
figure 5) soit les deux chromosomes de la paire n° 1 sont affectés (porteur homozygote, figure 6).
La résistance à la protéine C activée est un défaut génétique affectant aussi bien les hommes que les
femmes (trait autosomique dominant). Chez les parents au premier degré (enfants, parents, frères et
sœurs), le risque de présenter également ce trait est de 50 %. Une enquête familiale s’avère par
conséquent souvent utile, notamment chez les membres de la famille de sexe féminin préalablement
à tout traitement hormonal ou toute grossesse envisagés ou chez les femmes de la famille atteintes
de thrombose, avant de mettre en route le traitement approprié.
Une thrombose survenant généralement après la puberté, il n’est nécessaire d’examiner les enfants
qu’en fin d’école maternelle ou en primaire, et avant toute intervention chirurgicale programmée,
lorsqu’il est plus aisé d’effectuer des prises de sang.
Quelles sont les implications dans mon cas personnel ?
Les porteurs hétérozygotes présentent un risque accru d’accident thromboembolique multiplié par
un facteur de cinq à dix ; chez les porteurs homozygotes, le risque est 80 fois plus élevé. Dans les

situations à risque, ce qui dans le présent contexte signifie en particulier la prise d’œstrogènes sous
forme de comprimés (pilule, certaines préparations prescrites dans le cadre de la ménopause) et la
grossesse, le risque de récidive de thrombose augmente considérablement. Chez les porteuses
hétérozygotes prenant la pilule contenant de l’œstrogène, le risque est multiplié par un facteur de
35. Les autres situations à risque sont la chirurgie, un alitement prolongé (immobilisation),
pansements et plâtres de la jambe (plâtres, botte de Unna, attelles, par exemple), les voyages
prolongées en avion ou en voiture où l’espace réservé aux jambes est limité, le cancer, les maladies
associées à une perte hydrique (diarrhée, etc.).
Il a également été observé une incidence accrue de complications de la grossesse, ce qui signifie
que les femmes enceintes doivent faire l’objet d’une surveillance spéciale et, dans certains cas,
relèvent d’injections d’héparine.
En outre, certains médicaments sont susceptibles de majorer le risque de thrombose, comme la
cortisone sous forme de comprimés et des traitements anti-hormonaux (tamoxifène, etc.)
En quoi consiste le traitement ?
Il n’est pas possible de traiter le gène défectueux lui-même. Les porteurs de ce défaut génétique qui
ne présentent pas de symptômes et n’ont pas d’antécédents de thrombose n’ont pas besoin d’un
traitement au long cours bien qu’il soit nécessaire de les avertir des situations à risque mentionnées
plus haut et de pratiquer les injections d’héparines requises. Il est ainsi possible de prévenir la
thrombose de façon presque certaine, la thrombose ne survenant que rarement hors des situations à
risque citées ci-dessus.
L’administration d’un anticoagulant (Sintrom®, Coumadine®, Marcumar®) est recommandée suite
à une thrombose. Le traitement doit être poursuivi sur 6 à 12 mois en fonction de la gravité du
trouble. Toutefois, en cas d'événements thromboemboliques récidivants ou d’antécédents de
pathologies très sévères à type d’embolie pulmonaire ou de thrombose veineuse dans le cerveau ou
l’intestin, un traitement par phenprocoumone (Marcumar®) est préconisé. La décision s’effectuera
toujours au cas par cas, en prenant en compte un certain de nombre de points. L’existence
simultanée de plusieurs thrombophilies chez une même personne n’est pas un phénomène rare et de
nombreux patients présentent différentes modifications de la coagulation qui détermineront le choix
du traitement administré.
La pilule contraceptive et d’autres préparations à base d’œstrogène par voie orale doivent être
interrompues, sauf lorsqu’un traitement par phenprocoumone (Marcumar) s’avère nécessaire,
auquel cas la préparation hormonale peut être poursuivie.
Un traitement par l’aspirine, par exemple, est insuffisant dans la phase aiguë suivant une thrombose
ou comme prophylaxie dans des situations à risque.
L’administration d’héparine doit également être discutée lorsque la personne doit prendre un vol
d’une durée de plus de 4 heures d’affilée. Ces points sont à discuter avec votre médecin traitant.
L’héparine n’est pas nécessaire chez les patients qui sont déjà sous anticoagulants oraux.
Et si l’on envisage d’avoir un enfant ?
De nos jours, la présence d’un facteur V Leiden ne constitue plus un obstacle à la grossesse.
Chez les femmes victimes d’une thrombose antérieurement, un traitement par héparine de bas poids
moléculaire est instauré dès que la grossesse est confirmée, à raison d’une administration par jour.
Les femmes apprennent à s’injecter l’héparine par voie sous-cutanée dans un pli cutané de
l’abdomen. Ce n’est pas difficile. Les injections d’héparine doivent être pratiquées pendant six
semaines au maximum après l’accouchement, la thrombose survenant souvent dans la période
 6
6
1
/
6
100%