T Coagulation et thrombose racontées à Juliette

Raconté à Juliette
Correspondances en Onco-Hématologie - Vol. IX - n° 2 - mars-avril 2014
5353
Coagulation et thrombose
racontées à Juliette
M.C. Béné*
* Laboratoire
d’hématologie,
CHU de Nantes.
T
u vas retrouver dans ce dossier,
Juliette, la célèbre phrase d’Ar-
mand Trousseau faisant lui-même
le diagnostic de son cancer de l’esto-
mac en se réveillant un beau matin le
bras gonfl é par une phlébite : un caillot
dans une veine de l’avant-bras. Tumeurs
et thromboses sont effectivement asso-
ciées par toute une série de mécanismes
complexes de mieux en mieux com-
pris, et les hémopathies malignes ne
font pas exception à la règle comme
tu vas le lire ici. Il en résulte des
recommandations prophylactiques qui
s’avèrent très effi caces, mais qui ne
sont pas totalement dénuées d’effets
indésirables et qui nécessitent une sur-
veillance attentive.
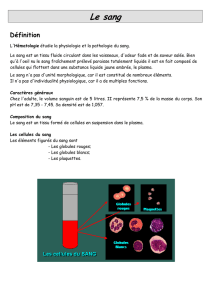
En effet, la coagulation du sang est une
cascade complexe et fi nement régulée
(fi gure)
qui a pour rôle majeur d’obs-
truer et d’aider à réparer les brèches
vasculaires. Elle ne doit cependant pas
se produire spontanément de manière
intempestive, car un vaisseau oblitéré
par un caillot ou un fragment de caillot
ne joue plus son rôle de transporteur
du sang. En cas de thrombose arté-
rielle, les tissus en aval souffrent vite
de l’ischémie et de la mort cellulaire
qui en résulte, générant selon le ter-
ritoire concerné infarctus ou accident
vasculaire cérébral. Lors des thromboses
veineuses qui sont les plus fréquentes,
notamment dans un contexte tumoral,
on observe le plus souvent une phlébite
et/ou une embolie pulmonaire.
Cette propriété étonnante du sang à
former un caillot de fi brine emprison-
nant les hématies, les plaquettes et les
globules blancs dans une masse vis-
queuse semi-solide est bien sûr connue
depuis la nuit des temps : les premières
blessures, les sacrifi ces d’animaux ou
l’épistaxis, avec l’étonnante exception
du sang menstruel qui ne coagule pas.
La légende dit que les anciens pen-
saient que le sang “mourait” en quittant
le corps et acquérait une forme de
rigidité cadavérique
(rigor mortis)
, ou
encore qu’il prenait en masse en refroi-
dissant. Cette théorie du refroidisse-
ment a persisté jusqu’en 1770, lorsque
William Hewson l’a remise en cause
en émettant l’hypothèse que l’absence
de mouvement et le contact de l’air
étaient en fait à l’origine de la forma-
tion du caillot. Il a ensuite montré que
Figure. Représentation schématique des voies d’activation de la coagulation.
En rouge : mécanismes inhibiteurs.
Voie intrinsèque
Facteur contact
Phase
contact
Facteur
tissulaire
Fibrinogène Fibrine
Caillot de fibrine
Kininogène
Kallicréine
Protéine C active
Protéine C + thrombomoduline
Prothrombine (II)
Protéine S
TFPI : Tissue Factor Pathway Inhibitor.
Thrombine (IIa)
Brèche vasculaire
XII XIIa VIIa VII
XIIIa XIII
XI XIa
IX IXa VIIIa
VIII
XXXa
Va
V
Voie extrinsèque
Facteur tissulaire
Voie commune
TFPI
Antithrombine

Raconté à Juliette
Correspondances en Onco-Hématologie - Vol. IX - n° 2 - mars-avril 2014
5454
le plasma (alors appelé lymphe) était
responsable de cette coagulation, et pas
les cellules. Mais il a fallu attendre
1905 pour que Paul Morawitz com-
mence à décrire la cascade de la coa-
gulation en montrant que, en présence
de calcium et de thromboplastine, la
prothrombine (baptisée facteurII) était
convertie en thrombine, à son tour
capable de transformer le fi brinogène
(facteurI) en un caillot de fi brine.
Diverses études de patients défi citaires
ont ensuite progressivement conduit
à la description des autres facteurs,
jusqu’au facteurXIII en 1965 et au
kininogène de haut poids moléculaire
en 1975.
Le rôle des plaquettes dans la forma-
tion du clou hémostatique avait com-
mencé à être suspecté dès 1882 lorsque
l’italien Giulio Bizzozero en a fourni
la première bonne description, les
baptisant
piastrine
traduit en français
par “petites plaques” puis évidemment
“plaquettes”. Rudolf Virchow avait déjà
démontré, en 1856, que le thrombus
initial était formé de fi brine et de
leucocytes. Bizzozero, en regardant ce
qui se passait après l’altération de la
surface de petites veines ou d’artères
avec une aiguille, écrivait en 1883 :
“Le matériel thrombotique est constitué
de quelques leucocytes dans de larges
amas de plaquettes”, et suggérait que
“ce matériel thrombotique peut être très
effi cace pour stopper les hémorragies
en bouchant les discontinuités d’une
paroi vasculaire”. Il avait également
remarqué que le réseau de fi brine ne
se formait que lorsque des plaquettes
s’étaient accumulées. L’histoire a gardé
la mémoire de farouches disputes entre
Bizzozero et Georges Hayem qui, pour
les Français tout au moins, a donné
son nom au fameux clou hémostatique.
Virchow est quant à lui l’auteur de la
triade éponyme des facteurs favorisant
la thrombose : variations hémodyna-
miques (stase, turbulence), dysfonction-
nement ou altération de l’endothélium,
et hypercoagulabilité.
Curieusement, il n’y a aucun élément
évocateur de phlébites ou de thromboses
dans les descriptions pathologiques de
l’Antiquité et le premier cas réellement
rapporté remonte au XIIIesiècle chez
un jeune homme de 20ans, guéri après
avoir appliqué, sur sa jambe gonfl ée et
fi stulisée, de la poussière recouvrant la
tombe de saint Louis. Plus qu’un cancer,
c’était chez lui sans doute une anomalie
congénitale de thrombophilie. Le diag-
nostic de thrombose a ensuite progressé
et on en retrouve une trace croissante
dans les traités de médecine. Cette
reconnaissance diagnostique a conduit
au développement de toutes sortes de
techniques pour enlever le caillot chirur-
gicalement si c’était possible, ligaturer le
vaisseau en cause pour fi xer le thrombus
ou au moins éviter son déplacement en
immobilisant le patient parfois dans des
carcans barbares. Au début du XXesiècle,
on tentait aussi de favoriser le retour
veineux et la circulation collatérale en
plaçant les patients dans des lits incli-
nés relevant les jambes et en appliquant
sur le membre atteint des compresses
chaudes.
Les approches thérapeutiques médica-
menteuses se sont développées pro-
gressivement, autour de la Première
Guerre mondiale, lorsque les chercheurs
essayaient de trouver des substances
procoagulantes pour favoriser le traite-
ment des plaies des soldats. En 1916, un
étudiant de deuxième année de méde-
cine, Jay McLean, qui travaillait chez
William Henry Howell sur les propriétés
procoagulantes de la céphaline extraite
du cerveau, se mit à appliquer la tech-
nique d’extraction de ce composé à des
extraits de foie. Surprise : il isole alors
une substance aux propriétés anticoa-
gulantes, in vitro et chez l’animal. Les
travaux se poursuivent chez Howell, et
l’origine hépatique des extraits obte-
nus (du grec
hepar
[foie]) dicte l’éty-
mologie de l’héparine. En fait, McLean
avait isolé des phospholipides, et la
véritable héparine, un mucopolysac-
charide, est présentée par Howell à la

Coagulation et thrombose racontées à Juliette
Correspondances en Onco-Hématologie - Vol. IX - n° 2 - mars-avril 2014
5555
Société américaine de physiologie et au
Congrès international de physiologie,
respectivement en 1922 et en 1926. Les
premières préparations sont impures et
ont des effets indésirables. Mais, à la
fi n des années 1930, un produit plus pur
et sans effet toxique entre en pratique
clinique. Le premier patient est traité en
1937, ce qui ouvre la voie à des appli-
cations potentielles de ce produit pour
les embolectomies, les greffes veineuses
et les embolies pulmonaires.
L’autre classe d’anticoagulants cou-
ramment utilisés, complémentaires de
l’héparine aux effets immédiats par
voie intraveineuse, sont les antivita-
miniquesK oraux. Leur découverte for-
tuite remonte au début du XXesiècle, où
dans les troupeaux des grandes plaines
d’élevage américaines se déclenche une
épidémie de maladies hémorragiques
fatales. Le coupable est identifi é dans
du trèfl e moisi, la crise contraignant
alors les agriculteurs à donner cet
aliment à manger à leurs bêtes. Pas
de trace d’infection, aucun élément
identifi é en dehors de l’association
avec cette consommation dans la quin-
zaine précédant le déclenchement de la
maladie. Les recommandations émises
sont d’éviter de donner cet aliment aux
bêtes et de transfuser celles qui sont
atteintes. Rien n’avance pendant 10ans,
lorsqu’un fermier, excédé, apporte un
bidon du sang incoagulable d’une de
ses vaches mortes à Karl Link qui vient
de commencer à s’intéresser à cette
maladie. En fractionnant systématique-
ment le trèfl e moisi, il fi nit, 6ans plus
tard, par démontrer que le coumarol du
trèfl e doux avarié est oxydé en dicou-
marol, fi nalement breveté en 1941. Link
pense alors à utiliser ce produit comme
raticide. Ses recherches sont fi nan-
cées par la Wisconsin Alumni Research
Foundation (WARF) et il entreprend de
modifi er le dicoumarol, d’action lente
(le bétail mourait en 30 à 50jours),
pour tenter d’obtenir un produit plus
actif. Sur 150dérivés, le 42e apparaît
comme particulièrement effi cace et
reçoit, en hommage à ses sponsors, le
nom de warfarine.
Entre temps, l’effi cacité de la vita-
mineK à inhiber l’effet anticoagulant
des coumariniques a été identifi ée.
On pense cependant que la warfarine
est trop toxique pour l’homme et elle
devient, à partir de 1948, un raticide
très utilisé. Jusqu’à la tentative de
suicide ineffi cace d’un jeune marine
conscrit qui avale en 5jours 567mg
de warfarine, ce qui démontre sa rela-
tive innocuité. Elle est introduite en
thérapeutique humaine en 1954.
Depuis, bien sûr, on a continué à tra-
vailler, et on a trouvé de nouveaux
anticoagulants oraux, agissant spéci-
fi quement sur la thrombine ou le fac-
teurXa.
Mais c’est une autre histoire…
■
• Mannucci PM. Venous thrombosis: the history of knowledge.
Pathophysiol Haemost Thromb 2002;32(5-6):209-12.
•
De Gaetano G. Historical overview of the role of platelets in hemostasis
and thrombosis. Haematologica 2001;86(4):349-56.
•
Galanaud JP, Laroche JP, Righini M. The history and historical treat-
ments of deep vein thrombosis. J Thromb Haemost 2013;11(3):402-11.
• McLean J. The discovery of heparin. Circulation 1959;19(1):75-8.
Pour en savoir plus…
L’auteur n’a pas précisé
ses éventuels liens
d’intérêts.
1
/
3
100%