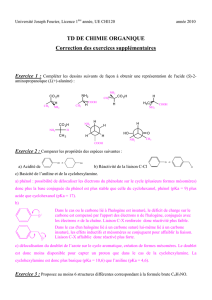
D- AMINE.2

61
Pr Amidou DOUCOURE: FAST-Université de Bamako. MALI & Dr Bakary KEÏTA: DER P/C-E.N.Sup. Bamako MALI
2D-LES AMINES
Caractérisées par la liaison , elles sont primaires, secondaires ou tertiaires suivant
que N est relié à un , deux ou trois atomes de carbone.
1°) Nomenclature
La terminaison –e de l’hydrocarbure parent devient –amine, avec un indice de localisation.
Remarques:
• Si N est sur un cycle benzénique il s’agit de benzénamines (ou anilines ou amines
aromatiques)
• Pour les amines II et III, on se refère au substituant le plus important de N et on
nomme les autres comme substituant(s) à la suite de N (N- ou N, N-)
• On peut les considérer comme des alkylamines (substituants par ordre alphabétique)
• Le préfixe amino est utilisé en présence d’une fonction prioritaire
(alcool,cétone,aldéhyde,acide et dérivés).Il en découle les noms en aminoalcanes.
, ,
, ,
• Les noms courants (historiques) sont fréquents : pyridine, nicotine, pipéridine:
, ,
NC
NH
2
3-méthylbutan-1-amine
NCH
2
CH
2
CH
3
CH
3
CH
2
CH
3
N-éthyl-N-méthylpropan-1-amine
N-éthyl-N-méthylaminopropane
HNCH
3
N-méthylbenzénamine
(N-méthylaniline)
N
Benzylcyclopropylméthylamine
NH
N-méthyl-2-méthylpropan-2-amine
N,2-diméthylpropan-2-amine
t-Butylméthylamine
N
pyridine
NN
CH
3
nicotine
N
H
pipéridine
NH
2
H
H
3
C
(R)-trans-pent-3-én-2-amine

62
Pr Amidou DOUCOURE: FAST-Université de Bamako. MALI & Dr Bakary KEÏTA: DER P/C-E.N.Sup. Bamako MALI
C C
H
NR
3
H
H
H
Et
HO
EtCH CH
2
+NR
3
B , t° (E2, élimination de Hoffmann)
alcène de Hoffmann
2°) Accès
Par de très nombreuses méthodes dont :
• Méthode de Hoffmann :
• Méthode de Gabriel :
• Réduction de nitriles, oximes, imines, nitroalcanes, azotures d’alkyle, amides, …
• Autres méthodes :
-
-
-
-
NH
O
O
+R X N
O
O
RR NH
2
B
- HX 2 KOH
- phtalate de K
phtalimide
C N +2 H
2
Ni, t°
ou AlLiH
4
CH
2
NH
2
Na NH
2
+R X H
2
N R
-NaX
R OH +NH
3
H
2
O+R NH
2
300°C
ZnCl
2
, NH
4
Cl
R C NH
2
O
NaOBr
+R NH
2
(dégradation d'Hoffmann)
(Br
2
/NaOH)
hypobromite de Na
NaBr - CO
2
-
R C X
ONaN
3
- NaX C
R N N N
OR N C O R NH
2
CO
2
t°
-N
2
H-OH + (Curtius)
halogénure d'acyle azoture d'acyle
isocyanate
H
3
N+R X H
3
N R, X H
2
N R
(jusqu'à l'halogénure d'ammonium quaternaire R
4
N, X )
Base
- HX

63
Pr Amidou DOUCOURE: FAST-Université de Bamako. MALI & Dr Bakary KEÏTA: DER P/C-E.N.Sup. Bamako MALI
3°) Caractéristiques physiques
De moins en moins solubles dans l’eau quand R de R-NH
2
augmente. Elles ont des T
éb
inférieures à celles des alcools homologues (liaisons H moins fortes).
- IR : N-H 3300 – 3500 cm
-1
(2 pics pour les amines I et 1 seul pour les amines II).
Vers 1600 cm
-1
(cisaillement de N-H)
C-N 1000 – 1300 cm
-1
-
1
H-RMN : H-C-N 2,2 – 2,9 ppm ; H-N de 0,6 à 6,0 ppm
- SM : ion moléculaire (M
+.
) impair pour un nombre impair de N.
4°) Réactivité
Elles sont basiques et nucléophiles (doublet libre sur l’azote) d’une part et acides (NH des
amines I et II moins acides que OH des alcools).
Les alkylamines sont plus basiques (III > II > I) que les benzénamines dont le doublet
participe à la résonnance d’autant plus que le noyau porte des substituants électons-attracteurs
(différents d’électrons-donneurs).
, bases à pKa >> 16 : KH(38), LDA (40) et BuLi (50) ou Na, K
La basicité des amines peut être évaluée par l’acidité de leurs acides conjuguées (pKa ≈ 10) ;
pKa
H-OH
= 15,7 et pKa
RO-H
= 16 -18.
Plus l’amine est basique plus son acide conjugué est faible (plus son pKa est grand).
Remarques: ces propriétés sont utilisées pour libérer les amines après acidification par HCl
aq,
alcalinisation du chlorure d’alkylaminium et extraction par un solvant organique :
N
H
H
H
3
C112,9° 105,9°
1,01
1,47 A
A
°
°
N R +CH C;NH R +H OH OH
N
H
H R +
Ka
pKa
Kb
= 50 pKa = 30 pKa = 15,7 pKa = 10 (aminium)
B
N H , ClR +OH NR +H OH +Cl
amine
chlorhydrate d'amine

64
Pr Amidou DOUCOURE: FAST-Université de Bamako. MALI & Dr Bakary KEÏTA: DER P/C-E.N.Sup. Bamako MALI
• Les sels d’ammonium quaternaire(comme des amines III) peuvent être optiquement
actifs :
a) Nucléophilie:
- Alkylation :
- Acylation :
- Nitrosation par le cation nitrosyle :
N
R
3
R
1
R
2
, X
R
4
Me
3
N+ Me X Me
4
N , X (Hoffmann)
halogénure de tétraméthylammonium
H O N O N O N O
H
H
2
O
-
H
R NH
2
N O R NH
2
N O - H
2
OR N N R
-
N
2
cation
diazonium
amine I
H
N O
NH R'R NH
R
R' N O N
R
R' N O
-
amine II N-nitrosodialkylamine
(cancérigène)
R
3
NN O R
3
N N O
amine III cation N-nitrosoammonium tertiaire
N+C
ZO N
H
C
Z
ON
H
CON C O
OH
H
2
O
-amide
Z = X, RO, RCOO
N+ C O N C
H
H
ON C
H
OH
N C imine
-H
2
O

65
Pr Amidou DOUCOURE: FAST-Université de Bamako. MALI & Dr Bakary KEÏTA: DER P/C-E.N.Sup. Bamako MALI
Remarques: 1°) les amines I subissent une désamination nitreuse conduisant au carbocation
très réactif (S
N
, E, réarrangements)
2°) si R = Ar, (arènediazonium plus stable, agent de synthèse)
Les amines III aromatiques sont nitrosées en position para (S
E
) :
b) Acidité:
c) Autres réactions:
- Test de Hinsberg (Ph-SO
2
-Cl, chlorure de benzènesulfonyle)
Les sulfonamides en 4-amino sont des sulfamides, agents de chimiothérapie :
R
NN O NNO
+
N H + CO
XHX
-N C Oamide
Ph SO
2
Cl amine II
amine III
amine I
SO
2
NHRPh sulfonamide
soluble en milieu basique rien
SO
2
NRR'Ph sulfonamide
en basique
SO
2
NHH
2
NN
N
sulfadiazine (antipaludéen)
Ar N
2
Ar N
2
, X
KI
HBF
4
CuCN
ArCN
ArF
ArI
H
2
O, t°
ArOH
ArH
Y
(colorants)
tétrafluoroborate
d'hydrogène
copulation
diazoïque
acide
hypophosphoreux PH
2
HO
O
()
Y
N=N Ar
 6
6
 7
7
 8
8
1
/
8
100%