Sélectivité en chimie organique

Sélectivité en chimie organique
Composé polyfonctionnel : réactif chimiosélectif, protection de fonctions.
I. Qu’est-ce qu’un réactif chimiosélectif ?
Différentes transformations en chimie organique.
1. Analyser le document
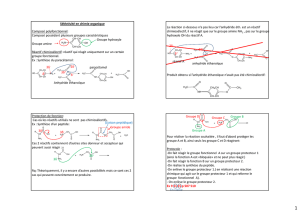
Dans le tableau ci-dessus, on étudie la réactivité d’une espèce inorganique (HBr ou PBr3) vis-à-vis
d’un alcène ou d’un alcool.
Pour chacun des exemples, déterminer la classe fonctionnelle des molécules avec lesquelles le
réactif inorganique interagit.
2. On s’intéresse au 3-méthylbut-2-èn-1-ol ou prénol, noté A, de formule :
Cette espèce chimique est dite polyfonctionnelle. Pourquoi ?
3. On s’intéresse à la réaction de la molécule A avec PBr3.
a. Quel produit obtient-on ?
b. Lors de cette transformation, PBr3 est dit chimiosélectif.
Proposer alors une définition de ce terme.
4. À votre avis, HBr est-il chimiosélectif vis-à-vis de A ?
II. Comparaison de deux voies de synthèse
Pour obtenir un produit B à partir d’un
réactif A, on
envisage deux possibilités de synthèse :
la voie α, en une seule étape, et la voie
β, en trois étapes. On constate
expérimentalement que la voie α ne
permet pas d’obtenir le produit
attendu, tandis que la voie. le permet,
avec un rendement global de l’ordre de
40 %.

La réaction de l’éthane-1,2-diol avec une espèce possédant le groupe carbonyle forme un acétal.
L’acétal formé peut de nouveau se transformer en éthane-1,2-diol s’il est mis en présence d’eau
acidifiée. On ne connaît pas d’autres réactions mettant en jeu des acétals.
Le tétrahydroaluminate de lithium LiAlH4 est couramment utilisé pour la réduction des réactifs
organiques. Il réduit les aldéhydes et les esters en alcool primaire, et les cétones en alcool secondaire.
1. Justifier le nom attribué à chacune des molécules A et B ?
2. Sur quel groupe caractéristique faut-il agir pour transformer A en B ?
3. Proposer une formule topologique pour le produit réellement obtenu par la voie α.
4. Proposer une formule topologique pour le produit formé lors de chacune des étapes de la voie β.
5. Pourquoi les trois réactions de la voie β sont dites sélectives.
6. Associer à chacune de ces trois étapes l’un des noms suivants : réduction ; protection ; déprotection.
III. La synthèse peptidique
Les dipeptides sont des molécules obtenues par réaction entre deux acides α-aminés, deux espèces
chimiques polyfonctionnelles. Montrons que la synthèse peptidique nécessite de protéger puis
déprotéger des groupes caractéristiques.
Document 1 : obtention d’un amide
On peut obtenir un amide à partir d’une amine et d’un acide carboxylique selon la suite de réactions ci-
dessous.
Document 2 : hydrolyse de l’aspartame :
L’aspartame est un édulcorant intense qui s’hydrolyse partiellement en un dipeptide que l’on notera D.

Document 3 : formule générale d’un acide α-aminé
Document 4 : Etapes simplifiés de la formation d’un amide (liaison peptidique – NH – CO – )
CNH
H
CN+C
HO-
OHH
C
O
OH
CN+C
HO-
OH
H
C
O
N
C
H
OH -
H+
1. Identifier les groupes caractéristiques du dipeptide D.
2. Écrire les formules topologiques des acides α-aminés dont il se compose :
– l’acide aspartique, de formule brute C4H7NO4
– la phénylalanine, de formule brute C9H11NO2
3. Combien de dipeptides différents peut-on obtenir à partir d’un mélange d’acide aspartique et de
phénylalanine ?
4. Pour obtenir un seul dipeptide au laboratoire, on effectue les étapes suivantes :
on protège un des groupe amino–NH2 et 2 groupes carboxyle ;
on active le groupe carboxyle restant en le faisant réagir avec du chlorure de thionyle ;
on fait réagir entre elles les deux espèces protégées ;
on déprotège les groupes caractéristiques.
a. Quel groupe caractéristique de la phénylalanine a été protégé lors de la synthèse de l’aspartame ?
b. Montrer que deux groupes caractéristiques ont été protégés dans l’acide aspartique lors de la
synthèse de l’aspartame.
c. Pour protéger la fonction amine, on substitue un hydrogène du groupe amino –NH2 par un
groupement – Z (exemple : - CO – O – CH2 – C6H5). Quel doit être le rôle du groupement du point de
vue du déplacement électronique ?
δ+

d. Pour protéger la fonction acide, on substitue l’hydrogène du groupe carboxyle –NH2 par un
groupement – Bz (exemple : - CH2-C6H5). Quel doit être le rôle du groupement du point de vue du
déplacement électronique ?
e. Faire un récapitulatif des différentes étapes à effectuer pour obtenir l’aspartame à partir d’acide
aspartique et de phénylalanine.

Etape de protection de – NH2 :
Le groupement NH2 est un groupe donneur
d’électrons (doublet non liant disponible). Par
contre ce n’est plus le cas de l’espèce formée au
cours de cette étape (R-NH-Z avec – Z : -CO-O-
CH2-C6H5)
Etape de protection de – COOH :
C’est une réaction d’estérification.
La substitution de l’hydrogène par le groupement
nommé Bz pour simplifier rend l’ester benzylique
peu réactif (moins accepteur d’électrons).
Avec – Bz : - CH2-C6H5
En réalité : protection des deux groupes –COOH
puis déprotection sélective avec LiOH
O
OH
O
OH
NH2
O
OH
O
OH
NH Z
O
O
O
OH
NH Z
Bz
NH2
O
OH
NH2
O
O
Bz
O
O
O
NH Z
Bz
NH
O
O
Bz
O
O
O
Cl
NH Z
Bz
Etape d’activation de la fonction carboxyle :
Ajout de chlorure de thionyle SO2
+
Etape de synthèse
O
OH
O
NH2NH
O
OH
Etape de protection de – COOH et –NH2
Par méthode commune :
hydrogénation sur palladium (H2 , Pd)
Etape de protection de – COOH
1
/
5
100%