Spectres IR. - martinphysique

Thème 1 :


a) rappels:
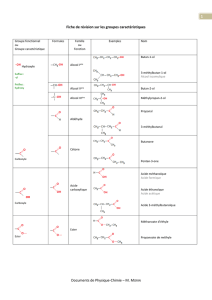
I) Nomenclature des composés organiques.
Fonction Alcool Aldéhydes Cétones Acide carboxylique
Groupe caractéristique R –O–H
Nom Hydroxyde Carbonyle Carbonyle Carboxyle
Fonction Alcène Ester Amine Amide
Groupe caractéristique
Nom Alcène Ester Amine Amide

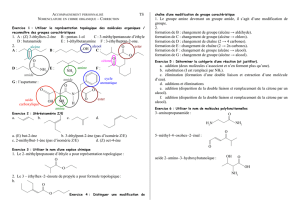
b) exemples:
Pent-1-éne (E)-pent-2-éne
(Z)-pent-2-éne 2,3-dimethylbut-2-éne

Autres exemples:
Éthanoate de méthyle Méthanoate de propyle.
Méthanoate d'éthyle Benzoate d'éthyle
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%