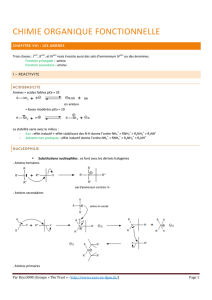
Réactifs Conditions Produits Nom Remarques Mécanisme

Réactifs Conditions Produits Nom Remarques Mécanisme
AMINES
R-N<
R’-I solvant : eau ou
éther amines supérieures synthèse
d’Hoffmann • SN
• obtention de mélanges
d’amines
voir Substitution Nucléophile
CH-C- + Ag2O
N(CH3)3
+
∆>C=C<
alcène Elimination
d’Hoffmann Régiosélectivité anti-Saytzev :
obtention de l’alcène le moins
substitué
CH3-CH2-CH-CH3 + Ag + OH AgI(s) + H2O +
+-
N(CH3)3
+
I-
CH3-CH=CH-CH3 + CH3-CH2-CH=CH2
minoritaire majoritaire
R’-OH Cat :
Al2O3,θ=350°C en
phase gaz
amines supérieures méthode de
Sabatier obtention de mélange d’amines R'-OH + R-NH2 H2O + N-H
R
R'
R'-OH + N-H
R
R'
H2O + N
R
R' R'
R’’-COOH froid sel d’acide • réaction acide-base
• ∆→ amide si amine primaire
ou secondaire R''-COOH + N-H
R
R' R''-COO NH2
R
R'
-+
R''-C NR'
R
O+ H2O
∆

R-C Cl
Oou
R-C
O
OC
O-R
(R-C O
A)
pyridine
amide
R-C O
Nacylation
• valable pour amines primaires
et secondaires ;
• la pyridine fixe l’acide libéré. R-C O
A+ N-H
R1
R2
R-C-NH
O
A
R1
R2
-+
R-C-N
OH
A
R1
R2R-C O
NR1
R2
+ A-H+
>C=O
cétone ou aldéhyde milieu H+
C=N
imine
• valable pour amine primaire ;
• imine très stable si aldéhyde
aromatique. C=O + R-NH2C
O
NH2-R
-+
C
OH NH-R H2O + C=N
acide nitreux
HNO2
milieu H+
θ entre 0 et 5°C dépend de la classe
de l’amine nitosation • NO2- + H+ → HNO2
• amine primaire→ alcool
ROH
• amine secondaire→ dérivé N-
nitrosé : R-N-N=O
R'
• amine tertiaire : rien.
HNO2 + H NO+ + H2O
+
R-NH2 + N=O R-NH2-N=O R-NH-N=O
-H+
+
+
R-N=N-OH H2O
H++ R-N=N R-N N
++
diazoïque
R-OH + N2(g) + H+
H2O
CF3CO3HR-NO
2oxydation valable pour amines primaires et
Ar-NH2
1
/
2
100%