Amines| Chimie organique• UE1
Tutorat Santé Lyon Sud (2016-2017) 1/7
Tutorat Santé Lyon Sud
UE1
Amines
Cours du Professeur N.Walchshofer
L’ensemble des cours du Professeur N.Walchshofer fait habituellement l’objet de 5 QCMs au
concours.
Le présent support de cours fourni par le Tutorat Santé Lyon Sud est destiné à faciliter votre prise de notes
mais ne constitue en aucun cas une référence pour le concours. Seuls les cours ayant été dispensés par les
enseignants et les supports mis à disposition par leurs soins sont légitimes. Veuillez prendre note que seul
les polycopiés directement téléchargés depuis Spiral Connect sont certifiés en provenance du tutorat, toute
autre source est potentiellement compromise.

Amines | Chimie organique • UE1
2/7 Tutorat Santé Lyon Sud (2016-2017)
SOMMAIRE
I. STRUCTURE......................................................................................................................................... 3
II. REACTIVITE ........................................................................................................................................ 3
II.A. RELATION STRUCTURE-REACTIVITE .......................................................................................................3
II.B. FORMATION D’AMMONIUMS PAR REACTION AVEC UN ACIDE .............................................................4
II.C. FORMATION D’IMINES PAR REACTION DES AMINES I AVEC LES ALDEHYDES ET LES CETONES ..............5
1. Réactions .............................................................................................................................................5
2. Mécanisme réactionnel ........................................................................................................................5
II.D. FORMATION D’ENAMINES PAR REACTION DES AMINES II AVEC LES ALDEHYDES OU CETONE .......................................6
1. Mécanisme réactionnel ........................................................................................................................6
2. Exemples ..............................................................................................................................................7

Amines| Chimie organique• UE1
Tutorat Santé Lyon Sud (2016-2017) 3/7
I. STRUCTURE
Amine : groupement fonctionnel amino lié à un ou plusieurs carbone(s). Il dérive d’un ammoniac (NH3),
avec un ou plusieurs H remplacés par un groupe carboné.
Attention : Ne pas confondre les amides avec les amines !!
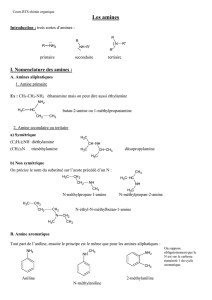
Classification : subdivisés en 3 classes en fonction du degré de substitution du N :
Type d’alcool
Propriétés
Amine primaire
Amine secondaire
Amine tertiaire
Substituants
1
2
3
Formule
II. REACTIVITE
II.A. RELATION STRUCTURE-REACTIVITE
L’azote est un atome électronégatif porteur d’un doublet libre, lié à au moins un H pour les amines I et II.
Sa réactivité générale est similaire à un alcool, modulée (plus basique qu’in alcool etc.).
Les différentes possibilités de réaction d’une amine sont fonction du milieu dans lequel elle est placée :
Propriétés acides : en présence d’une base extrêmement forte (rare)
- L’ion H+ peut facilement être capté par une base l’atome d’hydrogène a un caractère acide.
- Mais seulement si on a à faire à une amine primaire ou une amine secondaire.
Propriétés basiques : formation d’ammonium

Amines | Chimie organique • UE1
4/7 Tutorat Santé Lyon Sud (2016-2017)
- Présence du doublet libre au niveau de l’atome d’azote confère aux amines des propriétés basiques qui
se manifesteront vis-à-vis du proton H+ et qui permettront l’accès aux ammoniums.
- A l’inverse d’O+H qui n’était pas stable, pour les amines NH+ est assez stable pour être isolé, car l’azote
supporte mieux une charge positive que l’oxygène car il est moins électronégatif.
Propriétés nucléophiles : réaction avec des électrophiles E+
- Ce même doublet libre confère également aux amines un caractère nucléophile utilisé dans des
réactions envers des atomes électrophiles.
- L’entité obtenue est également assez stable pour être isolée.
II.B. FORMATION D’AMMONIUMS PAR REACTION AVEC UN ACIDE
La formation d’un ammonium s’effectue grâce au caractère basique de l’atome d’azote vis-à-vis du proton
H+ :
Il est important de noter que cette formation est un processus réversible par traitement de l’ammonium
obtenu avec une base forte (NaOH). La réaction acide-base conduit alors à la régénération de l’amine. (OH-
capture H+ pour former H2O.)
Exemples : Réaction avec l’acide chlorhydrique (HCl)
Par action de HCl, on obtient un sel appelé chlorure d’ammonium ou chlorhydrate d’amine.
En solution, cette réaction est équilibrée.
Remarque : L’atome d’azote s’accommode plus facilement d’une charge positive que l’atome
d’oxygène. En conséquence, les composés issus d’une protonation de l’atome d’azote des amines sont
stables et isolables, contrairement aux formes protonées des alcools et des thiols.

Amines| Chimie organique• UE1
Tutorat Santé Lyon Sud (2016-2017) 5/7
II.C. FORMATION D’IMINES PAR REACTION DES AMINES I AVEC LES ALDEHYDES ET LES
CETONES
1. Réactions
- Réaction réalisée sous catalyse acide, utilise les propriétés nucléophiles de l’atome d’azote.
- Réaction équilibrée éliminer l’eau au cours de sa formation pour un meilleur rendement.
2. Mécanisme réactionnel
Le groupement carbonyle (C=O) est un électrophile car il y a une mésomérie avec C+ et O-.
Mécanisme en 2 temps :
1) Formation d’un aminoalcool.
2) Formation de l’imine par déshydratation de l’aminoalcool.
Le mécanisme réactionnel est composé de 4 étapes :
Fixation de H+ par le carbonyl (activation par le catalyseur)
Addition nucléophile de l’azote de l’amine (I, II, III) sur le C électrophile de l’aldéhyde ou du cétone utilisé.
Formation du 1er intermédiaire, avec une charge – sur O et une charge + sur N.
Stabilisation de cet intermédiaire chargé, par transfert de H conduisant à un aminoalcool neutre.
 6
6
 7
7
1
/
7
100%