27 Chapitre 25 : Les amines aliphatiques Attention : quand on parle

CHAPITRE 25 : LES AMINES ALIPHATIQUES
27
Chapitre 25 : Les amines aliphatiques
Attention : quand on parle d’amine primaire, secondaire, tertiaire ou quaternaire, on
parle du degré de substitution de l’atome d’azote et non du carbone porteur de la fonction
(comme dans les autres cas).
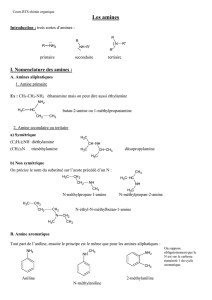
25.1.Nomenclature des amines 173-174
Pour une amine simple, on ajoute juste le suffixe –amine à la fin du nom du substituant
alkyl porteur de la fonction. Exemple : cyclohexylamine, 1,4-butanediamine,…
Pour les composés avec plus d’un groupe fonctionnel, on considérera le –NH2 comme
un substituant –amino de la molécule parente.
Exemples :
C
O
OH
NH
2
COOH
NH
2
NH
2
H2N
O
Acide 2-aminobutanoïque Acide 2,4-diaminobenzoïque 4-amino-2-butanone
Les amines secondaires et tertiaires symétriques sont nommées en ajoutant le préfixe
di- ou tri- devant le nom du groupement alkyl.
Exemple : diphénylamine, triéthylamine.
Il existe aussi quelques noms usuels :
NH2
NH
2
CH
3
Aniline m-Toluidine
Amines cycliques :
L’atome d’azote sera toujours le n°1.
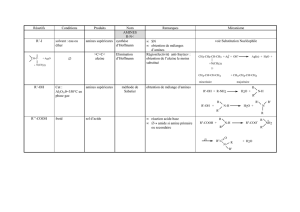
25.2. Structures et liaisons dans les amines 175-176
L’atome d’azote est sp³
Un atome d’azote portant 3 substituant différents ne sera pas chiral (N.B. il y a quand
même quelques exceptions quand le basculement en parapluie n’est pas possible). Par
contre, un sel d’ammonium portant 4 substituants différents sera chiral.
25.3. Propriétés physiques des amines 177
Comme pour les alcools, les amines avec moins de 5 carbones seront en général
soluble dans l’eau. De même, les amines primaires et secondaires formeront beaucoup de
liaisons hydrogènes.
25.4. Basicité des amines 178-183
L’azote possède une paire libre, l’azote aura donc un caractère basique mais aussi
nucléophile. La basicité d’une amine ne dépend pas de ses substituants.

CHAPITRE 25 : LES AMINES ALIPHATIQUES
28
Ce caractère basique des amines va permettre de purifier les amines. En effet, si l’on
acidifie la solution, on va récupérer l’amine protonée en phase aqueuse et les composés
neutres dans la phase organique. Si après cela, on ajoute de la base et de l’éther sur cette
phase aqueuse, l’amine va redevenir neutre et passer en phase organique.
Comparaison avec les amides :
Un amide n’as pas de caractère basique car :
-Si l’on protone un amide, on perd la stabilisation par résonance (l’amide est
stabilisé par la délocalisation de la paire libre de l’azote sur le carbonyle).
-Le groupe carbonyle électroattracteur va déstabilisé par effets inductifs la
charge positive voisine due à la protonation.
Acidité des amines :
Les amines sont des acides extrêment faibles (pKa de l’ordre de 35-40).
25.5. Résolution ou dédoublement des énantiomères 184-185
cf. cours de première
25.6. Sources et usage industriel de amines 186
NH
3
+ CH
3
OH CH
3
NH
2
+ (CH
3
)
2
NH + (CH
3
)
3
N + H
2
O
Al
2
O
3
450°C
Ce mélange est facilement séparable par distillation mais par contre, cela ne marche
pas super bien avec des composés plus élaborés.
25.7. Synthèse des amines au laboratoire 187-200
Les amines sont d’excellent nucléophile dans les réaction Sn2. On va donc pouvoir
synthétiser des amines en alkylant de l’ammoniac. Le problème est que la réactivité de
l’amine secondaire est a peu prêt identique à celle du produit de départ, la réaction va
donc continuer et on aura un mélange de produits de polyalkylation ce qui n’est pas très
intéressant malgré les rendements très bon. Il va donc falloir développer des méthodes de
synthèse plus sélectives.
-Synthèse des amines via les azotures
L’ion azoture N3- est une espèce non basique mais néanmoins hautement
nucléophile.
RX
+ NaN3EtOH RNN N +NaX
RN
3H2 / Pd RNH
2
RN
3
RNH
2
1.Li
A
lH
4
2.H
2
O
Les rendements sont excellents mais le problème est que les azotures de faible masse
moléculaire sont explosifs, il faut donc les manipuler avec précaution.
-Synthèse des amines via la synthèse de Gabriel
Synthèse de Gabriel = Alkylation d’un imide suivi de son hydrolyse en milieu basique
pour donner une amine primaire. Le mécanisme de l’hydrolyse d’un imide est le même a
peu de chose prêt que celui d’un amide (on a 2 fonction amide en fait).

CHAPITRE 25 : LES AMINES ALIPHATIQUES
29
CNH
C
O
O
KOH
EtOH CN
C
O
O
RX
DMF CN
C
O
O
R
+KX
OH- / H2ORNH2 +
CO2-
CO2-
-Réduction des amides et des nitriles
On peut réduire assez facilement un amide ou une cétone en amine grâce au LiAlH4.
Si l’on utilise un réducteur moins puissant, comme le DIBAH (-78°C), on s’arrêterait à un
intermédiaire iminé qui pourrait être hydrolysé pour donner un aldéhyde.
De la même manière, on va pouvoir réduire un lactame en amine cyclique avec
LiAlH4.
-Amination réductrice des cétones et des aldéhydes
H
2
CCCH
3
O
NH
3
H
2,
Ni Raney
H
2
CCH CH
3
NH
2
+ H
2
O
On va pouvoir ainsi synthétiser des amines primaires, secondaires et tertiaire.
Cependant, H2 étant assez explosifs, on utilisera d’autres agents réducteurs. Le plus utilisés
étant le cyanoborohydrure de sodium (NaBH3CN)
Mécanisme :
H2
CCCH3
O
NH3
H2, Ni Raney
H2
C
NH2
OH
CH3H2
CCCH3
NH +H2O
H2
CCH CH3
NH2
La première partie est le mécanisme de l’addition d’une imine (vu en première) et la
seconde partie est la réduction catalytique de l’imine en amine.
Réarrangement d’Hofmann et réarrangement de Curtius
Réarrangement d’Hofmann
RC
O
NH
2
NaOH,Br
2
H
2
ORNH
2
+ CO
2
Réarrangement de Curtius
RNH
2
+ CO
2
+ N
2
NNN
C
R
OH
2
O
T >>
N.B. Dans les 2 cas, on va raccourcir la chaîne carbonée de 1 carbone.

CHAPITRE 25 : LES AMINES ALIPHATIQUES
30
Mécanisme du réarrangement de Hofmann
RC
O
NH
H
OH
-
RC
O
NHBr Br RC
O
NH
Br
Bromoamide
OH
-
RC
O
NBr
RNC O + Br
-
isocyanate
H
2
ORN
H
C
O
OHRNH
2
+ CO
2
acide carbamique
123
456
1 : Réaction acide/base, le produit est stabilisé par résonance
2 : Bromation de l’amide primaire
3 : Réaction acide/base, le produit est stabilisé par résonance
4 : Réarrangement de l’anion provenant du bromamide. Le groupe R va commencer
sa migration vers l’azote voisin pendant que l’ion bromure quitte cet atome d’azote (différent
des réarrangement de carbocation ou le groupe R commence sa migration après le départ
de l’halogènure).
5 : Addition nucléophile sur le carbone de la fonction isocyanate. Si on délocalisait la
charge sur l’oxygène, on retomberait sur le produit de départ.
6 : Décarboxylation
Mécanisme du réarrangement de Curtius :
Le mécanisme est similaire à celui de Hofmann (migration d’un groupement R
simultanément au départ d’un groupe partant).
NNN
C
R
O
RNC O + N
2
RNH
2
+ CO
2
25.8.Réaction des amines 201-204
Acylation des amines primaires et secondaires
Chlorure d’acide Amine primaire
Anhydride d’acide + Amine secondaire Î
Amide
On utilisera toujours un excès d’amine afin d’éviter la formation de HCl. Si l’amine est
coûteuse, on utilisera plutôt un excès d’une autre base.
On avait déjà remarquer un analogie en terme de réactiovité des chlorures d’acide
et des chlorures d’acides sulfonique, on aura donc aussi une sulfonylation des amines.
RSO2Cl + R’NH2 Î RSO2NHR’
On utilise cette réaction pour réaliser le test de Hinsberg qui permet de différencier
une amine primaire, secondaire ou tertiaire ( une amine primaire donnera un produit soluble
en milieu basique, une amine secondaire un produit insoluble en milieu basique et une amine
tertiaire réagira pour redonner les réactifs de départ).
Elimination de Hofmann
1
ère étape : méthylation exhaustive de l’amine par l’iodométhane Æ formation
d’un sel d’ammonium quaternaire.
RNH2 + CH3I (excès) Î RN+(CH3)3 I-

CHAPITRE 25 : LES AMINES ALIPHATIQUES
31
2ème étape : E2 en présende d’Ag2O
Ag2O + RN+(CH3)3 I- Î Ag2I + 2 RN+(CH3)3 OH-
On va donc ainsi former des ions OH- qui pourront réaliser la réaction
d’élimination et on formera ainsi l’alcène le moins substitué (contrairement à la
déshydratation des alcools ou l’on formait l’alcène le plus substitué.
25.9.Les sels d’ammonium quaternaire sont des agents de transfert de phases 205-206
Cf. notes de labo
25.10. Les amines naturelles : les alcaloïdes 207-208
On appelle ces amines alcaloïdes car leurs solutions aqueuses sont légèrement
basiques.
1
/
5
100%