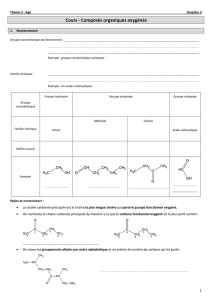
OXYDATION DES ALCOOLS

OXYDATION DES ALCOOLS
On va étudier dans ce chapitre l’oxydation ménagée des alcools.
Ce type de réaction fait intervenir un oxydant (espèce chimique capable de capter un ou plusieurs
électrons) et un réducteur (espèce chimique capable de céder un ou plusieurs électrons).
Ce sont des réactions d’oxydoréduction rencontrées en classe de première.
On parle d’oxydation ménagée s’il n’a pas modification de la chaîne carbonée de la molécule.
I. OXYDATION MENAGEE: IMPORTANCE DE LA CLASSE DE L’ALCOOL
L’oxydation des alcools peut se faire avec défaut de réactif ou avec excès d’oxydant.
La classe d’un alcool (vu au chapitre “Révision en chimie organique”) peut être déterminée par
l’étude de son oxydation. Les différents cas sont représentés ci-dessous :
II. METHODE POUR DETERMINER LA CLASSE DE L’ALCOOL
Connaissant le résultat de l’oxydation, on peut en déduire la classe de l’alcool. On prendra comme
oxydant l’ion MnO
4-
de coloration violette.
- Si après réaction la solution est décolorée alors l’alcool de départ était primaire ou secondaire
car les alcools tertiaires ne s’oxydent pas.
- Si le test à la 2,4-DNPH est positif (apparition d’un précipité jaune), le produit présente un
groupe carbonyle. Il s’agit donc d’une cétone ou d’un aldéhyde. On doit effectuer un test
supplémentaire pour conclure.
- Si le test au réactif de Fehling est positif (apparition d’un précipité rouge brique), on a affaire à
un aldéhyde donc l’alcool oxydé est primaire. Dans le cas contraire, l’alcool de départ était secondaire
- Si l’oxydation conduit à un composé acide, l’alcool de départ était primaire. L’acidité du produit
peut être testé à l’aide de papier pH.
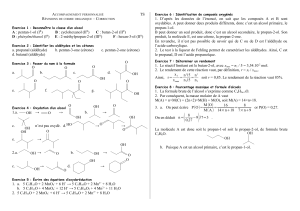
Exercice :
Un alcool a pour formule brute C
4
H
10
O
1- Représenter, en formule semi développées, les 4 isomères possibles et les nommer.
2-Donner la classe de chaque isomère
3- En supposant que lors de la réaction d’oxydation, on a obtenu du butanal, quel est l’alcool de
départ ?

On peut résumer les différents cas à l’aide de l’organigramme ci-dessous :
III. OXYDATION D’UN ALCOOL PRIMAIRE.
1. Oxydation limitée
Un alcool primaire s’oxyde en aldéhyde. Il est donc le réducteur du couple oxydant / réducteur:
aldéhyde / alcool primaire.
Ecrire l’équation d’oxydation de l’éthanol par l’ion permanganate.
Les couples sont MnO
4-
/Mn
2+
et C
2
H
4
O/C
2
H
6
O
Les demi-équations sont : MnO
4-
+ 8H
+
+ 5e = Mn
2+
+ 4H
2
O (x2)
C
2
H
6
O = C
2
H
4
O + 2H
+
+ 2e (x5)
2 MnO
4-
+ 5 C
2
H
6
O +6H
+
= 2 Mn
2+
+ 5C
2
H
4
O + 8H
2
O
Une application à l’oxydation de l’éthanol est le test d’alcoolémie. L’oxydant est ici l’ion dichromate
qui se transforme en ion chrome de coloration verte. L’intensité de la couleur permet de connaitre la
quantité d’éthanol présente au départ
2. Oxydation totale
Un alcool primaire s’oxyde en aldéhyde. L’aldéhyde produit peut, dans certaines conditions s’oxyder
à son tour en acide carboxylique.
Ecrire l’équation d’oxydation de l’éthanal par l’ion permanganate.
Les couples sont MnO
4-
/Mn
2+
et C
2
H
4
O
2
/C
2
H
4
O
Les demi-équations sont :

MnO
4-
+ 8H
+
+ 5e = Mn
2+
+ 4H
2
O (x2)
C
2
H
4
O + H
2
O = C
2
H
4
O
2
+ 2H
+
+ 2e (x5)
2 MnO
4-
+ 5 C
2
H
4
O +6H
+
= 2 Mn
2+
+ 5C
2
H
4
O
2
+ 3H
2
O
3. Oxydation des sucres réducteurs
Les sucres possédant une fonction aldéhyde sont des aldoses. Leur fonction aldéhyde peut s’oxyder,
ce qui fait de bons réducteurs.
Remarques.
Ils réagissent à la liqueur de Fehling. Le glucose est un sucre réducteur.
Certains sucres ne contenant pas de fonction aldéhyde, comme le lactose, sucre présent dans le lait,
réagissent quand même à la liqueur de Fehling. Ce sont donc aussi des sucres réducteurs.
Par contre, le saccharose, sucre que l’on trouve en abondance dans la canne à sucre, n’est pas un
sucre réducteur. il ne réagit pas à la liqueur de Fehling.
IV. OXYDATION D’UN ALCOOL SECONDAIRE.
Un alcool secondaire s’oxyde en cétone. Il est donc le réducteur du couple oxydant / réducteur:
cétone / alcool secondaire.
Ecrire l’équation d’oxydation du propan-2-ol par l’ion permanganate.
Les couples sont MnO
4-
/Mn
2+
et C
3
H
6
O/C
3
H
8
O
Les demi-équations sont : MnO
4-
+ 8H
+
+ 5e = Mn
2+
+ 4H
2
O (x2)
C
3
H
8
O = C
3
H
6
O + 2H
+
+ 2e (x5)
2 MnO
4-
+ 5 C
3
H
8
O +6H
+
= 2 Mn
2+
+ 5 C
3
H
6
O + 8H
2
O
Application. L’acide lactique est un des produits fabriqués par l’organisme lors de la production
d’énergie par des muscles. Son passage dans le sang, lors d’un effort prolongé et d’une mauvaise
oxygénation, provoque l’apparition de crampes. L’acide lactique contient à la fois une fonction
acide carboxylique et une fonction alcool secondaire. Il s’oxyde donc dans l’organisme en acide
pyruvique, qui contient une fonction cétone.
Donner la formule de ces deux molécules
1
/
3
100%