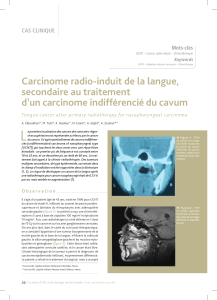
Schéma de l`essai multicentrique de phase II évaluant

Objectif primaire : Evaluer le taux de réponses objéctives clinique en RECIST obtenu après 3 cycles d’une stratégie thérapeutique néo-adjuvante de DOCETAXEL à la dose de 75mg/m² en association avec Cisplastine à la dose de
75mg/m², et après radiothérapie conventionnelle, dans le carcinome indifférencié de type nasopharyngé
Objectifs secondaires : - Evaluation de la réponse radiologique après chimiothérapie et radiothérapie - Evaluation de la réponse pathologique - Evaluation de la durée de réponse
- Evaluer le temps jusqu’à progression - analyse de survie globale - Analyse de la tolérance
Chimiothérapie
Radiothérapie
Follow-up
3 Cycles de 21 jours
Tous les 3 mois jusqu’au décès
J1
J71
J22
J64
J43
J85
J106
J148
J127
J-7
J-28
Cycle 1
Cycle 3
Cycle 2
Evaluation post
chimiothérapie
Evaluation post
radiothérapie
Fin de l’étude
Début de l’étude
Schéma de l’essai multicentrique de phase II évaluant en néo-adjuvant l’association Docetaxel plus Cisplatine chez des sujets atteints
d’un carcinome indifférencié de type nasopharynge
Critères d’inclusion
- Consentement éclairé daté et signé.
- Carcinome nasopharyngé OMS II-III histologiquement prouvé sur biopsie du cavum.
- UNCT stade III, IVA, IVB selon classification UICC/AJC 1997 avec N2 ou N3 et adénopathies > 3cm et
sans métastases à distance.
- Age ≥ 20 et ≤ 75 ans.
- Statut de performance ≤ 1 ou indice karnofsky ≥ 70%.
- Espérance de vie > 3 mois.
- Sujet jamais traité antérieurement pour ce cancer.
- Fonctions hématologiques, hépatique et rénales normales, réalisées 7 jours avant l’inclusion.
- Fonction cardiaque normale.
Critères de non-inclusion
- Reçu précédemment pour son UCNT, une chimiothérapie et/ou radiothérapie et/ou chirurgie curatrice.
- UCNT stade III, IVA, IVB, avec N0 et N1, N2, N3 ≤cm (classification UICC/AJC 1997).
- Localisation métastasique à distance.
- Carcinome nasopharyngé histologiquement prouvé (biopsie du cavum).
- Diagnostic histologique fait sur biopsie ganglionnaire.
- Antécédents d’une tumeur cancéreuse sauf carcinome in situ du col utérin ou cancer basocellulaire cutané
ou autre cancer traité curativement durant les 5 dernières années.
- Femmes enceintes ou allaitant et sujet en âge de procréer (mis sous contraception)
- Antécédents de défaillance organique majeure
- Traitement concomitant par corticoïdes ≥ 20mg de méthyle-prednisolone dans les 6 mois précédents
l’étude
- Autre traitement anticancéreux durant l’étude
- Pas de traitement anticancéreux pendant l’étude.
- Traitement expérimentale 30 jours avant l’étude
- Participation à une autre étude
- Etat social ou psychique ne permettant pas une bonne compliance au traitement et au suivi médical
- Allergie au polysorbate 80
J-28 J-7 J1 J14 J22 J36 J43 J57 J64 J64-J71 J127-J148 Follow-up
Consentement éclairé x
Examen physique x x x x x x x Tous les 3 mois
Examen du cavum x x x x x x x Tous les 3 mois
Indice de performance x x x x x x
Biopsie du cavum x x
Scanner du cavum x x x 1 fois/ an
Rx du thorax x1 fois/an
Echographie abdominale x1 fois /an
Scintigraphie osseuse x1 fois / an
ECG x
Echographie cardiaque x
Biopsie médullaire Optionnelle
Hématologie x x x x x x x x x x
Biochimie x x x x x x x
Evènements Indésirables x x x x x x x x
Pré- inclusion
Inclusions : 22 patients/centre
3 à 6 semaines après la chimiothérapie
J14
J36
J57
1
/
1
100%