A Hormonothérapie des cancers du sein métastatiques : le point en 2012

8 | La Lettre du Sénologue • n° 56 - avril-mai-juin 2012
DOSSIER THÉMATIQUE Prise en charge du cancer du sein métastatique :
la bataille n’est pas perdue !
* Service d'oncologie médicale,
hôpital Avicenne, Bobigny.
Hormonothérapie des cancers
du sein métastatiques :
le point en 2012
What's new for treatment of advanced breast cancer in 2012
Laurent Zelek*
A
u cours des dernières décennies, l’hormono-
thérapie a parfois fait figure de parent
pauvre de la thérapeutique antitumorale,
la chimiothérapie monopolisant l’attention des
oncologues. Il ne faut cependant pas oublier que
l’hormonothérapie reste le plus ancien traitement
médical des tumeurs solides puisque les premières
observations de réponses tumorales après ovariec-
tomie remontent au XIXe siècle (1).
Quatre périodes historiques peuvent être distinguées :
➤
Jusqu’au début des années 1970, le traitement
reposait sur les techniques ablatives, en premier lieu
ovariectomie mais également surrénalectomie (afin
de supprimer la sécrétion d’estrogènes au niveau
surrénalien), voire hypophysectomie. L’ovariectomie
chirurgicale a par la suite pu être remplacée par
la radiothérapie ovarienne, puis, plus récemment,
par la suppression ovarienne réversible au moyen
d’agonistes LH-RH.
➤
Dans les années 1970, le tamoxifène s’est
imposé : il s’agit d’un antagoniste des estrogènes
qui conserve cependant un effet agoniste sur certains
tissus (en premier lieu l’endomètre), ce qui explique
le nombre d’effets indésirables observés (figure 1).
D’autres traitements sont utilisés à cette période :
progestatifs (qui gardent aujourd’hui des indications
limitées en phase palliative), mais également andro-
gènes et estrogènes à fortes doses qui sont tombés
en désuétude. Dans le même temps, la compréhen-
sion de la biologie des cancers du sein connaît un
développement important avec la mise en évidence
des récepteurs aux hormones stéroïdes, estrogènes
(RE) et progestérone (RP).
➤
À la fin du XX
e
siècle, les inhibiteurs de l’aromatase
(IA) [figures 2] font l’objet de nombreux essais cliniques
en phase métastatique, puis au cours de la décennie
suivante en situation adjuvante. Les agents actuelle-
ment utilisés inhibent de façon sélective la dernière
étape de la synthèse surrénalienne des estrogènes, par
aromatisation des androgènes (et succèdent à l’orimé-
tène qui réalisait une surrénalectomie chimique néces-
sitant une supplémentation en hydrocortisone). Ils ne
sont actifs que chez les patientes ménopausées chez
qui la synthèse d’estrogènes se fait au niveau périphé-
rique, mais ils n’agissent pas sur la synthèse ovarienne
d’estrogènes chez les femmes non ménopausées.
➤Au cours des dernières années (figure 3), la meil-
leure compréhension des voies de transduction du
signal dans les cellules tumorales a conduit au déve-
loppement de thérapeutiques ciblées, qui commencent
a être associées à l’hormonothérapie. Les résultats
d’associations avec les anti-HER2 ont notamment été
récemment publiés (2, 3), d’autres types d’associations,
probablement plus intéressants, sont en cours de déve-
loppement (par exemple avec les inhibiteurs de mTOR).
Figure 1. Années 1970 : une stratégie thérapeu-
tique simple !
Séno 56juin.indd 8 26/06/12 09:11

La Lettre du Sénologue • n° 56 - avril-mai-juin 2012 | 9
Points forts Mots-clés
Hormonothérapie
Thérapeutiques
ciblées
Évérolimus
Possibilités thérapeutiques
actuelles
Nous avons actuellement à notre disposition 6 classes
thérapeutiques (figure 4 p. 10), en particulier chez
la femme ménopausée, les IA n’étant pas actifs chez
la femme dont la fonction ovarienne est conservée.
➤
Le tamoxifène, actif que la patiente soit méno-
pausée ou non, est le chef de file des modulateurs
sélectifs des RE (Selective Estrogen Receptor Modu-
lators [SERM]) : il s’agit de molécules apparentées qui
présentent un effet antagoniste sur le tissu mammaire
et des effets agonistes plus limités sur les autres
tissus, un exemple en étant le raloxifène utilisé dans
la prévention de l’ostéoporose et secondairement chez
les femmes à risque de cancer du sein. Le torémifène
est apparenté au tamoxifène, mais son utilisation
demeure marginale. Il n’y a pas d’autre SERM actif
dans le cancer du sein commercialisé en France.
➤La suppression ovarienne a des indications plus
limitées que par le passé et fait de nos jours essen-
tiellement appel aux agonistes LH-RH. L’ovariec-
tomie demeure une possibilité, mais elle est le plus
souvent pratiquée par cœlioscopie. La suppression
ovarienne peut être associée au tamoxifène en phase
métastatique chez la patiente non ménopausée.
➤Les IA sont de 2 types :
– les IA non stéroïdiens (anastrozole et létrozole),
Figure 2. Années 1990 : la stratégie devient plus complexe avec l'arrivée des inhibi-
teurs de l'aromatase...
TAM : tamoxifène ; IANS : IA non stéroïdiens ; EXE : exémestane.
Figure 3. Années 2000 : la grande confusion ?
IANS: IA non stéroïdiens, EXE: exémestane, FV: fulvestrant, P: progestatifs, TAM: tamoxifène.
* Schéma adjuvant séquentiel. En grisé : options thérapeutiques moins utilisées. LEs flèches
pleines désignent des options validées par des essais cliniques ou un niveau de preuve suffisant,
les flèches pointillées désignent des options pour lesquelles le niveau de preuve est faible.
»
La sélection des patientes hormonosensibles est une étape fondamentale dans la stratégie thérapeutique,
elle repose sur l’expression des récepteurs hormonaux et sur des données cliniques simples.
»Chez des patientes sélectionnées, l’hormonothérapie est aussi efficace que la chimiothérapie.
»En cas de réponse ou de stabilité prolongé avec une première ligne d’hormonothérapie, la probabilité de
contrôle de la maladie par des lignes successives n’est pas négligeable.
»
L’association d’une hormonothérapie à l’évérolimus, inhibiteur de mToR, est sans doute une avancée
thérapeutique importante.
Highlights
»
Selection of hormone respon-
sive patients is a critical issue ;
it is mainly based on hormone
receptor status and clinical
criteria.
»
In selected patients hormone
therapy yields the same efficacy
as chemotherapy.
»
In patients who experience
clinical benefit with a first line
of hormone therapy, other types
of hormone therapy given at
progression can remain effec-
tive in a substantial proportion
of patients.
»
The association of hormone
therapy to targeted therapies
such as mToR inhibitors seems
very promising.
Keywords
Hormone therapy
Targeted therapy
Everolimus
Séno 56juin.indd 9 26/06/12 09:11

10 | La Lettre du Sénologue • n° 56 - avril-mai-juin 2012
DOSSIER THÉMATIQUE Prise en charge du cancer du sein métastatique :
la bataille n’est pas perdue !
qui réalisent une inhibition compétitive et réversible
du cytochrome p450 ;
– l’exémestane, qui est le seul représentant des IA
stéroïdiens. Il réalise une inhibition non réversible du
cytochrome p450. Il n’y a pas de résistance croisée
entre ces 2 types d’IA ce qui ouvre évidemment la
voie à des stratégies de switch en situation métas-
tatique (4).
➤
Le fulvestrant (5) est un antiestrogène pur, de
structure stéroïdienne contrairement au tamoxifène,
il est responsable d’un blocage complet et irréver-
sible des RE qui sont ensuite catabolisés.
➤
Les progestatifs (mégestrol ou médroxyproges-
térone) gardent un intérêt limité pour le traitement
de rattrapage des phases métastatiques, notamment
en raison de leur effet orexigène qui peut permettre
d’améliorer l’état général de certaines patientes. Ils
sont toutefois responsables d’une augmentation
significative du risque thromboembolique.
Fulvestrant : molécule originale
qui a pâti d’un développement
initial erratique…
Le fulvestrant est un antiestrogène pur, dépourvu
de toute activité agoniste : il entraîne un blocage
total du RE ainsi qu’une augmentation de son cata-
bolisme. De ce fait, toute activation transcription-
nelle est abolie, ce qui se traduit notamment par
une absence de synthèse des RP alors que celle-ci
persiste, bien que réduite, sous tamoxifène. Ainsi
le fulvestrant fait preuve d’une supériorité sur le
tamoxifène dans des modèles précliniques. Le terme
de Selective Estrogen Receptor Destructor (SERD)
a été proposé pour rendre compte de son méca-
nisme d’action.
Par ailleurs, le fulvestrant est dépourvu d’effet
agoniste sur les autres tissus ; en théorie il doit
donc avoir un index thérapeutique supérieur à celui
du tamoxifène.
Malheureusement, les premiers essais randomisés
comparant le fulvestrant au tamoxifène puis à
l’anastrozole n’ont pas permis d’établir une quel-
conque supériorité sur les traitements de référence
(5). Le fait est que le schéma d’administration initial
n’a pas pris en compte la voie d’administration i.m.
du produit avec une résorption lente due à un exci-
pient huileux : avec une injection intramusculaire
(i.m.) mensuelle de 250 mg, il faut 3 mois pour
atteindre des taux sériques efficaces (6) !
Récemment, le schéma d’administration optimal
a été précisé : il comporte des injections de
500 mg à J1, J14 et J28 la posologie étant ensuite
de 500 mg/28 j (6). À ces doses, le fulvestrant se
révèle supérieur à l’anastrozole avec un bénéfice
significatif en termes de survie sans progression.
De surcroît, il faut souligner que le fulvestrant
Figure 4. Les différentes classes thérapeutiques.
Séno 56juin.indd 10 26/06/12 09:11

La Lettre du Sénologue • n° 56 - avril-mai-juin 2012 | 11
DOSSIER THÉMATIQUE
administré après échec des IA non stéroïdiens a
une efficacité comparable à celle de l’exémestane :
dans l’essai EFFECT portant sur 660 patientes, la
durée médiane de réponse est de 13,5 mois versus
9,8 pour l’exémestane, avec des taux de bénéfice
clinique, respectivement de 32,2 et 31,5 % et de 29,1
et 27,2 % sur les métastases viscérales (7). Si le taux
de réponse objective demeure faible (de l’ordre de
7 %), de tels résultats sont loin d’être négligeables
en situation de rattrapage !
Le fulvestrant a pour l’instant été essentiellement
développé chez les patientes ménopausées, mais
des essais sont en cours chez les femmes non méno-
pausées.
Choix du traitement en phase
métastatique
L’hormonothérapie ne concerne que les tumeurs
hormonosensibles et il est utile en premier lieu de
rappeler les critères d’hormonosensibilité en phase
métastatique :
– positivité des RH ; l’hormonosensibilité des formes
RE+ RP+ est considérée comme plus élevée que celle
des formes avec RE et RP dissociés (au sein de ces
dernières, il est classiquement admis que les RE–
RP+ sont plus hormonosensibles que les RE+ RP) ;
– intervalle libre long, au moins 2 ans, idéalement
plus de 5 ans ;
– grade et/ou index de prolifération peu élevés ;
– pas de lésion viscérale menaçante ou rapidement
évolutive (exemple typique des localisations hépa-
tiques ou des lymphangites pulmonaires).
Soulignons que l’existence de lésions métastatiques
viscérale n’est pas en soi une contre-indication systé-
matique à l’hormonothérapie !
Par ailleurs, les patientes ayant eu un bénéfice clinique
(réponse objective ou stabilisation supérieure à 6 mois)
avec une première ligne d’hormonothérapie ont une
probabilité élevée de répondre à une deuxième ligne,
sauf en cas d’apparition de lésions viscérales évolutives.
Diverses options sont possibles, mais les essais
cliniques ne répondent pas à la question spéci-
fique de la prise en charge des rechutes en cours
d’IA adjuvant, qui deviennent un cas de figure de
plus en plus fréquent :
– chez une patiente rechutant sous tamoxifène
ou à distance de la fin du traitement adjuvant, on
proposera un IA compte-tenu de la supériorité de
cette classe thérapeutique en première ligne métas-
tatique ;
– dans le cas d’une rechute sous IA, on peut en
changer, notamment pour l’exémestane dont
l’efficacité après échec d’un IA non stéroïdien est
démontrée (7) ; passer au fulvestrant, dont l’effi-
cacité est comparable à celle de l’exémestane (7),
ou au tamoxifène, qui est efficace et demeure une
option après échec des IA.
Pour les lignes ultérieures d’hormonothérapie, les
options sont difficilement schématisables : fulves-
trant, passage à un autre IA, tamoxifène, voire
progestatifs.
Dans le cas particulier des femmes non ménopau-
sées, lorsqu’une hormonothérapie est indiquée, il
est possible d’ajouter au tamoxifène une suppression
ovarienne par agoniste LH-RH, ce type d’associa-
tion étant considéré comme le schéma de référence
avant la ménopause (1). L’alternative, notamment
en cas de rechute sous tamoxifène est d’associer un
IA à la suppression ovarienne mais cette attitude,
bien que répandue, n’est pas étayée par des essais
cliniques randomisés dans cette population. Il n’est
cependant pas rare que les patientes ayant reçu des
lignes antérieures de chimiothérapie soient rendues
ménopausées par le traitement, en particulier en
cas de lignes multiples chez des patientes âgées
de plus de 40 ans.
Association avec les traitements
ciblés et réversion
de l’hormonorésistance
(figure 5 p. 12)
Blocage de la voie HER2
Récemment, l’association IA + trastuzumab a été
testée chez des patientes atteintes de cancers
métastatiques RH+ HER2+ : si les résultats du
bras expérimental se révèlent supérieurs à ceux
de l’hormonothérapie seule, les résultats de cette
dernière étant très modestes, cela soulève la ques-
tion de l’hormonosensibilité de ce type particulier
de tumeurs (2). Un autre essai a été réalisé avec
l’association lapatinib + létrozole montrant des
résultats assez similaires (3).
Au final, les espoirs fondés sur une éventuelle synergie
entre traitement anti-HER2 et hormonothérapie ont,
dans une certaine mesure, été déçus. Dans la pratique
quotidienne rares sont les patientes chez qui ce type
de stratégie peut être envisagé en première ligne,
car les critères d’évolutivité et la présence fréquente
de localisations viscérales agressives feront souvent
Séno 56juin.indd 11 26/06/12 09:11

12 | La Lettre du Sénologue • n° 56 - avril-mai-juin 2012
DOSSIER THÉMATIQUE Prise en charge du cancer du sein métastatique :
la bataille n’est pas perdue !
préférer une association à la chimiothérapie. En
revanche, après obtention d’une réponse considérée
comme maximale, il est raisonnable d’associer l’hor-
monothérapie au traitement anti-HER2 si la tumeur
exprime des récepteurs hormonaux (en l’absence
toutefois d’essai prospectif randomisé). Une situa-
tion particulière mérite enfin d’être notée : celle des
patientes âgées présentant des comorbidités rendant
la chimiothérapie non souhaitable.
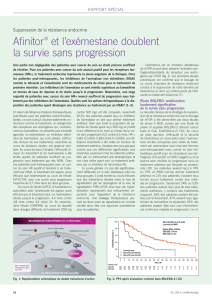
Blocage de mTOR par l’évérolimus :
la stratégie d’avenir ? (figure 6)
Les résultats précliniques montrant l’importance
de l’activation de la voie PI3K dans l’acquisition de
l’estrogéno-indépendance se trouvent confirmés de
manière magistrale par l’étude BOLERO-2, dont
les données actualisées avec un suivi médian
de 12,5 mois ont été rapportées au San Antonio
Breast Cancer Symposium en décembre 2011, de
manière contemporaine de la publication dans le
New England Journal of Medicine (8). Une popula-
tion de 724 patientes présentant un cancer du sein
RE+ échappant au létrozole ou à l’anastrozole a été
randomisée (2:1) entre exémestane + évérolimus
10 mg/j et exémestane + placebo. Les résultats
sont sans appel : gain en survie sans progression
(SSP) de 7 mois (11,0 versus 4,1 mois ; HR = 0,36 ;
p < 1 x 10
-16
!) ; bénéfice identique dans tous les
sous-groupes, notamment dans le groupe avec
métastase viscérale ; nette tendance au bénéfice
en survie (données non matures) ; pas de différence
en qualité de vie, malgré une majoration réelle des
effets indésirables : mucite, rash, fatigue, diarrhée,
perte d’appétit, nausées. Le bénéfice d’une associa-
tion de l’évérolimus au tamoxifène avait par ailleurs
été montré dès 2010 dans l’essai TAMRAD (9) avec
pratiquement un doublement du temps à progres-
sion. Ces résultats semblaient particulièrement nets
chez les patientes avec une hormonosensibilité
initiale, mais cela n’a pas été retrouvé dans l’essai
BOLERO-2 (8).
De nombreuses questions concernant la place
de l’évérolimus restent à clarifier dans un proche
avenir : doit-on le réserver au traitement de rattra-
page des patientes hormonosensibles ou existe-
t-il un bénéfice à le prescrire précocement, dès le
début de l’hormonothérapie ? Y a-t-il un intérêt
à utiliser des lignes d’hormonothérapies succes-
Figure 5. Intégration des différentes thérapeutiques ciblées
Séno 56juin.indd 12 26/06/12 09:11
 6
6
1
/
6
100%