Les amines

Chimie - 7 ème année - Ecole Européenne
Ecole Européenne de Francfort Page 177
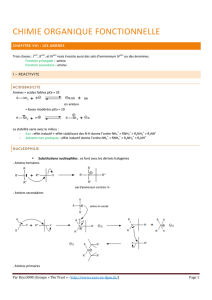
Chapitre n° 13 : LES AMINES ET LES AMIDES
I) Présentation des amines
1)
:
Définition
L'azote a pour numéro atomique Z = 7
:
Avec 5 électrons de valence l'azote est trivalent.
L'atome d'azote peut réaliser trois liaisons avec trois atomes d'hydrogène
pour former l'ammoniac NH3 :
représentation représentation modèle
de Lewis de Cram éclaté
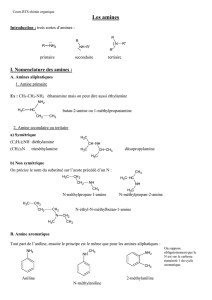
Les amines sont des corps dérivés de l'ammoniac NH3. Il existe 3 sortes d'amines :
Amine primaire
amine secondaire
amine tertiaire
2) Nomenclature
* Pour nommer les amines primaires, on nomme l'alcane dont elles dérivent et on remplace
le suffixe ane par ylamine.
:
ex. :
CH3
–
CH2
–
CH2
–
CH2
–
NH2
butylamine
* Pour les amines secondaires et tertiaires on cherche la chaîne carbonée la plus longue
parmi R, R' et R"; cette chaîne détermine le nom de l'amine primaire sur l'azote de laquelle
on a substitué 1 ou 2 atomes d'hydrogène par un groupe carboné. On fait précéder le nom
de la partie amine primaire des noms des parties substituées précédées encore de N-.
ex. :
CH3
–
CH2
–
CH2
–
NH
–
CH3
N-méthylpropylamine
ex. :
N-éthyl-N-méthylpropylamine
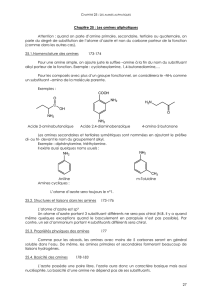
3) Exemples d'amines
a) Amines primaires :
:
- L'éthylamine (CH3 – CH2 – NH2) : Intermédiaire en synthèse organique pour la fabrication
d'agents tensio-actifs, de produits phytosanitaires ou pharmaceutiques, de colorants, de
plastifiants ... solvant extractif, notamment pour le raffinage d'huiles minérales ou
végétales.
- La phénylamine ou aniline : ou
L'aniline est utilisée dans l'industrie chimique
comme base de la préparation de nombreux
produits.
La substance brute est incolore, odoriférante et d'aspect huileux,
C'est un produit cancérigène et mutagène.

Les amines
Page 178 Christian BOUVIER
b) Amines secondaires :
- La diéthylamine ((CH3 – CH2 – NH – CH2 – CH3) : Intermédiaire en synthèse organique
pour la fabrication de produits phytosanitaires, pharmaceutiques ou photographiques, de
produits ignifugeants, inhibiteurs de corrosion, émulsifiants ... agent dispersif ou
solubilisant pour peintures et vernis.
- La diphénylamine (C6H5 – NH – C6H5) : la diphénylamine est utilisée
comme stabilisant dans les propergols.
La diphénylamine peut être utilisé comme indicateur acido-basique.
c) Amines tertiaires :
- La triméthylamine ((CH3)3N) : substance mise en évidence dans l'haleine, l'urine, la
sueur et la salive. La triméthylamine est produite par certaines bactéries.
- N,N-diméthyl-2-méthylpropylamine :
La molécule contient deux groupes méthyle
fixés sur l'atome d'azote (N,N) et un groupe
méthyle fixé sur le deuxième atome de
carbone (-2-) de la chaîne la plus longue
(propyle).
II) Propriétés physiques des amines
Les propriétés physiques sont influencées par l'existence de liaisons hydrogène qui possèdent
toutefois une intensité moindre que chez les alcools de masse molaire comparable, car l'atome
d'azote est moins électronégatif que l'atome d'oxygène.
:
1) Température d'ébullition
Les températures d’ébullition des amines sont plus élevées que celles des hydrocarbures de
structure comparable, mais moins élevés que celles des alcools correspondants.
:
alcane
θéb
amine
θéb
alcool
θéb
méthane −
162 °C
ammoniac −
33,4 °C
eau + 100 °C
éthane −
88,6 °C
méthylamine −
6,3 °C
méthanol + 64,5 °C
propane − 42,2 °C éthylamine + 16,6 °C éthanol + 79,5 °C
diéthylamine + 7,7 °C
butane − 0,5 °C propylamine + 48,6 °C propanol + 97,2 °C
triméthylamine + 3,5 °C
Les amines secondaires et surtout tertiaires ont des températures d'ébullition plus basses
que les isomères primaires. Les amines les plus légères, CH3NH2, (CH3)2NH, (CH3)3N,
CH3CH2NH2, sont gazeuses à 20°C. Les autres sont des liquides ou des solides.
2) Solubilité
Les amines de faible masse molaire sont miscibles à l'eau.
:
Les premiers termes conservent certaines des propriétés physiques analogues à celles de
l’ammoniac, notamment leur grande solubilité dans l’eau et leur "odeur ammoniacale"
caractéristique.
De fait, les amines de poids moléculaire un peu plus élevées ont une forte odeur de poisson.
Les amines benzéniques Φ – NH2 sont des liquides visqueux, ou des solides, insolubles
dans l’eau et à l’odeur désagréable.

Chimie - 7 ème année - Ecole Européenne
Ecole Européenne de Francfort Page 179
III) Propriétés chimiques des amines
1)
:
Généralités
Les liaisons C – N et N – H sont polarisées à cause de l’électronégativité de l’azote.
:
D’autre part, l’azote possède un doublet libre. La situation est donc comparable à celle des
alcools, mais étant donné que l’azote est moins électronégatif que l’oxygène, la réactivité
des amines sera donc différente de celle des alcools.
La disponibilité du doublet libre étant plus grande, les amines sont plus basiques que les
alcools.
La réactivité des amines se "concentre" sur l’azote et son doublet libre.
2) Propriétés basiques
Comme l'ammoniac, les amines sont des bases de Bronsted. Elles réagissent avec l'eau en
se comportant comme des bases faibles :
:
B + H2O
←
→
BH+ + OH−
Couple valeur du pKA du couple
ion ammonium/ammoniac 9,25
ion méthylammonium/méthylamine 10,64
ion diméthylammonium/diméthylamine 10,72
ion éthylammonium/éthylamine 10,73
ion triméthylammonium/triméthylamine 9,80
ion propylammonium/propylamine 10,84
ion phénylammonium/phénylamine 4,62
Mis à part la phénylamine, les amines sont donc des bases faibles plus fortes que
l'ammoniac.
La basicité des amines est due à des effets inductifs donneurs des groupes résiduels R, qui
stabilisent l’acide conjugué plus que la base en "comblant" partiellement le déficit
électronique sur l’azote. Cet effet inductif donneur favorise le caractère basique des amines.
Mais pour les amines tertiaires, les facteurs d’encombrement stériques expliquent la difficulté
pour l’azote de capter un ion H+ diminuant ainsi son caractère basique.
3) Réaction avec les halogénures
- Les halogénures, iodures par exemple, réagissent à chaud en solution alcoolique avec
l'ammoniac, puis avec les amines qui se forment :
(réaction d'Hoffmann) :
CH3 – I + NH3 → CH3 – NH2 + HI
puis CH3 – I + CH3 – NH2 → CH3 – NH – CH3 + HI
et enfin CH3 – I + CH3 – NH – CH3 → + HI
On obtient un mélange des trois amines.
- Les amines tertiaires réagissent avec un halogénure pour donner le sel d'ammonium
quaternaire correspondant : (CH3)3N + CH3 – Cl → [(CH3)4N]+ + Cl−
- Les amines réagissent à chaud en présence d'un catalyseur (ZnCl2) avec les alcools de la
même manière :
On a R – OH + R' – NH2 → R – NH – R' + H2O
puis R – OH + R – NH – R' → + H2O
4) Réaction de l'hydrogène
Les amines primaires ou secondaires présentent une polarisation de la liaison N – H
comparable à la polarisation de la liaison R – OH des alcools.
:

Les amines
Page 180 Christian BOUVIER
Comme les alcools, ces amines réagissent avec les métaux alcalins pour donner des corps
décomposés par l'eau, des amidures, (comme les alcoolates) :
CH3 – NH2 + Na → CH3 – NH− + Na+ +
2
1
H2
Puis en présence d'eau : CH3 – NH− + Na+ + H2O → CH3 – NH2 + Na+ + OH−
5) Diazotation des amines
a) Introduction :
:
Les colorants azoïques constituent une famille importante de colorants dont la synthèse a
commencé vers 1860 en Allemagne et en Angleterre.
Le composé de base est une amine aromatique primaire (par exemple l’aniline ou l’un de
ses dérivés).
La préparation du colorant azoïque implique deux étapes successives :
- la diazotation d'une amine;
- le couplage du diazonium obtenu avec un naphtol : la copulation diazoïque
b) Exemple de diazotation :
Le rouge de paranitroaniline est préparé à partir d'une réaction de diazotation.
L'énorme inconvénient de ces réactions réside dans les conditions opératoires. En effet, il
ne faut pas dépasser les 5°C. Au dessus de 5°C le produit peut se dégrader de façon
explosive et libérer de l'azote.
Remarque : En fonction du traitement de ce sel de diazonium on peut obtenir un composé
qui va réagir dans une réaction de diazotation comme précédemment pour
former un composé tel qu’un phénol :
c) Mécanismes réactionnels :
On considère la réaction de l'aniline avec l'acide nitreux HNO2.
Le composé obtenu est un sel de diazonium.
Remarque : L'acide nitreux est instable à température ordinaire, il se décompose par une
réaction de dismutation : 3 HNO2 → 2 NO + NO3− + H3O+
(HNO2/NO E0 = 1,00 V) et (NO3/HNO2 E0 = 0,94 V)
Il faut donc le préparer au moment de son utilisation (in situ) par action de
l'acide chlorhydrique sur le nitrite de sodium :
H3O+ + Na+ + NO2− → HNO2 + Na+ + H2O

Chimie - 7 ème année - Ecole Européenne
Ecole Européenne de Francfort Page 181
Il faut le conserver à 0°C pendant le temps de la réaction (cela diminue la
vitesse de décomposition par dismutation).
Le mécanisme est le suivant :
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%