universite pierre et marie curie lc204 2010-2011 xamen de

UNIVERSITE PIERRE ET MARIE CURIE
LC204 2010-2011
EXAMEN DE CHIMIE ORGANIQUE
10 janvier 2011, session 1 - Durée de l’épreuve : 2 heures
L’épreuve comporte deux problèmes indépendants dont la durée de traitement est fournie à titre indicatif. Ils seront
traités sur deux copies différentes. L’usage des documents est interdit. Votre copie doit être rédigée à l'encre bleue ou
noire uniquement.
Problème 1 (1h30)
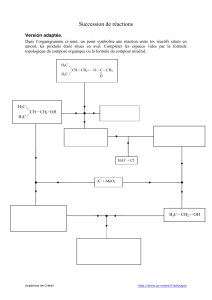
La Tropinone représente l’intermédiaire clé pour la synthèse des alcaloïdes de type tropanes,
produits naturels aux propriétés médicinales. Ce composé est isolé à partir de diverses plantes de la
famille des Solanaceae telles que l’Atropa Belladonna. Après quelques modifications chimiques, la
Tropinone permet l’accès à de nombreux dérivés, les plus fameux étant la Cocaïne et l’Atropine.
Première partie : Synthèse de la Tropinone
La première synthèse de la Tropinone a été réalisée en 1898 par Willstätter puis nettement
améliorée en 1917 par Robinson. La Tropinone F est ainsi obtenue avec un nombre d’étapes réduit
à partir du succinaldéhyde A, de la méthylamine B et du dianion acétone dicarboxylate de calcium
D.
1. Proposer un mécanisme réactionnel pour la synthèse de l’intermédiaire iminium C non isolé,
sachant que l’on passe par un premier intermédiaire non cyclique de type imine.
Tropinone
Cocaïne Atropine
O
NH3C
CHO
CHO
+ NH2CH3N CH3
OH
C
H+
AB
+
O
O
O
O
O
Ca
DE
!
Tropinone F
O
NH3C
COOH
COOH
O
NH3C
N CH3
OH
C

Formation du premier intermédiaire non cyclique de type imine :
Formation de l’intermédiaire iminium C non isolé :
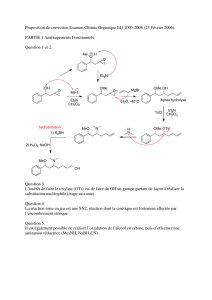
Deuxième partie : Synthèse de la Cocaïne à partir de la Tropinone
N
Li
LDA
F
1°/ LDA
2°/ CO2
3°/ H3O+
Tropinone réductase I
NADPH
O
NH3C
G
CO2H
O
NH3COH
NH3C
H
CO2H
1
2
CHO
H
O
+H+
CHO
H
OH
CHO
H
OH
HNH
Me
CHO
H
OH
+
OH
NMe
H
H
OHC
La suite du mécanisme pouvait être
traitéé avec l'une ou l'autre des deux
formes mésomères
OH
NMe
H
H
OHC
Prototropie OH
NMe
H
OHC
H
OH
NMe
H
OHC
HNMe
OHC
H
+H2O
Le passage par une forme carbocation stabilisée
par l'effet mésomère donneur de l'azote
peut également être envisagée avec le départ de la
molécule d'eau
NMe
OHC
HNMe
OHC
Formation du premier intermédiaire et
régénération du catalyseur acide
+ H+
A
B
NMe
H
O
+H+
NMe
H
OH
NMe
H
OH
La suite du mécanisme pouvait être traitée
avec l'une ou l'autre des deux formes
mésomères
NMe
H
OH
N Me
OH
C

2. Sachant que le LDA (diisopropylamidure de lithium) est une base forte, écrire le mécanisme
réactionnel pour l’étape F G.
3. La Tropinone réductase I associée au NADPH (Nicotinamide Adénine Dinucléotide Phosphate)
permet de réaliser de manière stéréosélective la transformation G H. Quel est le nom de cette
réaction ?
Réduction
4. Proposer un réactif chimique que l’on pourrait utiliser pour réaliser la même réaction G H,
sans tenir compte de la stéréochimie finale.
NaBH4 (l’emploi de LiAlH4 n’est pas recommandé dans ce cas car trop réducteur)
5. Suite à cette réaction, seul l’isomère (1S, 2R) peut conduire à la Cocaïne sous sa forme active.
Préciser la stéréochimie sur la représentation du composé H (justifier en indiquant l’ordre de
priorité des substituants).
I
MeOH/ H+
J Cocaïne C17H21NO4
OH
N
H3C
H
CO2H
OCOPh
NH3C
CO2H
?
F
O
NH3C
H
+BO
NH3CO
NH3C
Li
Li
+BH+
La suite du mécanisme pouvant être effectuée sur l'une ou l'autre des deux formes mésomères
O
NH3CLi +C
O
O
O
NH3C
O
OLi
O
NH3C
O
OLi
+ H+O
NH3C
O
OH
G
OH
NH3C
H
CO2H
1
2C1*: OH > C2 > C3 > H
3
4
C2*: CO2H > C1 > C4 > H
(S)
(R)

6. Quels sont le ou les réactifs nécessaires pour effectuer la réaction H I.
Ou PhCOOH / H+
Pyridine
7. Donner la structure de la Cocaïne J.
8. Ecrire le mécanisme réactionnel pour l’étape I J (on pourra simplifier l’écriture). Quelle est
le nom de cette réaction ?
Mécanisme :
Nom de la réaction : Esterification
Troisième partie : Synthèse de l’Atropine à partir de la Tropinone
Cette synthèse nécessite la préparation préalable du chlorure d’acide P.
Cl Ph
O
J
OCOPh
NH3C
CO2Me
R OH
O
+H+
R OH
OH
R OH
OHLa suite du mécanisme pouvant être
effectuée sur l'une ou l'autre des deux
formes mésomères
R OH
OH
+Me OHROH
OH
OMe
H
ROH
OH
OMe
H
Prototropie
ROH
OH
OMe
H
RO
OH
OMe
H
HR OMe
OH
+ H2OLe passage par une forme carbocation
intermédiaire stabilisée par l'effetmésomère
donneur de l'oxygène est aussi envisageable
R OMe
OH
R OMe
O
+H+Formation de l'ester et régénération du
catalyseur acide

9. Quels sont le ou les réactifs nécessaires pour effectuer la réaction K L.
Cl2 / H+
10. Donner la structure du composé M.
11. Ecrire le mécanisme réactionnel pour l’étape L M (on pourra simplifier l’écriture).
H
O
H
O
Cl
Ph Ph H+
K L
M
KCN
H3O+, !
HCO2H
Ph
O
O
SOCl2H
Ph
P
O
Cl
O
?
N
DMSO
HO OH
N
DMSO:
Diméthylsulfoxyde
H
Ph
M
OO
Cl
R H
O
+H+
R H
OH
R H
OHLa suite du mécanisme pouvant être effectuée sur l'une
ou l'autre des deux formes mésomères
R H
OH
+RH
OH
O
H
HO OH
OH
Prototropie
RH
OH
O
H
RH
OH
O
H
OH OH
R H
+ H2OLe passage par une forme carbocation
intermédiaire stabilisée par l'effet mésomère donneur de l'oxygène
est aussi envisageable après le depart de la molécule d'eau
RH
OH
O
H
OH
OO H
R H
OO H +H+
R H
OO Formation de l'acétal et régénération du catalyseur acide
 6
6
 7
7
 8
8
1
/
8
100%