CHIMIE ORGANIQUE TD n°2

PAES – Chimie Organique – TD n°2 Année 2010-11
- 1 -
1
ère
Année des Etudes de Santé
Année 2010/11
CHIMIE ORGANIQUE
TD n°2
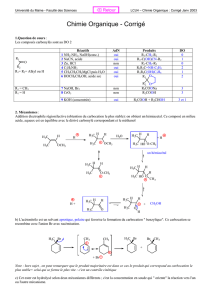
1) a) Indiquez la nature des effets électroniques (+I, -I, +M, -M) exercés par chacun
des groupements en rouge dans les molécules suivantes. En déduire la polarisation
de la liaison a dans les molécules A, B et C en indiquant les charges partielles.
b) Ecrire toutes les formes mésomères possibles pour les molécules C et D.
2) Détaillez les formes de résonance (ou formes mésomères) au sein des systèmes
conjugués suivants :
3) a) Détaillez les éléments stabilisants les carbocations suivants (NB : Dans certains
cas l’écriture de formes mésomères est indispensable).
b) En déduire l’ordre de stabilité de ces intermédiaires réactionnels.
4) Complétez les structures de Lewis et décrivez à l’aide de flèches les déplacements
électroniques dans les réactions ci-dessous. De quel type de réaction s’agit-il ? A
l’aide des valeurs de pKa (annexe), calculez la constante d’équilibre de la réaction a).
a)

PAES – Chimie Organique – TD n°2 Année 2010-11
- 2 -
b)
5) Classez par ordre d’acidité croissante les molécules suivantes. Expliquez.
a) CH
3
CH
2
OH, CH
3
CH
2
CH
3
, CH
3
CO
2
H, CH
3
CH
2
NH
2
.
b)
6) Donnez les produits des réactions suivantes et le sens de l’équilibre.
a)
CH
3
Li + CH
3
CH
2
CH
2
CH
2
NH
2
b) CH
3
C≡CH + NaOCH
3
c) HC≡CNa + H
2
O
d)
CH
3
OH + NaNH
2
e)
CH
3
CO
2
H + CH
3
ONa
f) CH
3
OH + NaOH
7) Classez ces composés par ordre de basicité croissante. Justifiez votre réponse.
8) Classez par ordre de nucléophilie croissante les 4 molécules suivantes. Justifiez
votre classement.
9) Indiquez par une flèche les sites précis susceptibles d’être attaqués par un
nucléophile.

PAES – Chimie Organique – TD n°2 Année 2010-11
- 3 -
Acide Base pK
a
HO S
O
O
OH
HO S
O
O
O
–10
ClH
Cl
–7
O
RR
H
O
RR
–4 à –7
O
H
RR
ORR –2 à –4
R O H
H
R O H
–2
HO
H
H
H
O
H
–1,74
ON
O
O H
ON
O
O
–1,4
Ar N
H
H
H
Ar N
H
H
3 à 5
R O H
O
R O
O
3 à 5
OH
O
O
O
4,76
HO C
O
OH
HO C
O
O
6,35
H
3
C
O
CH
3
O
H H
H
3
C
O
CH
3
O
H
9
Ph P
Ph
OEt
O
H H
Ph
Ph P
Ph
OEt
O
Ph
H
9
H N H
H
H
H N
H
H
9,24
Ar O
H
Ar O
8 à 11
R N H
R
R
R N
R
R
10 à 11
HO C
O
O
OC
O
O
10,33
H
3
C
O
OCH
3
O
H H
H
3
C
O
OCH
3
O
H
11
H
3
CO
O
OCH
3
O
H H
H
3
CO
O
OCH
3
O
H
13
H
3
C O
H
H
3
C O
15,2
H
O
H
HO
15,74
OH
O
16
O
NH
2
R
O
NHR
17
O
RR
H H
O
RR
H
19 à 20
O
RO R
H H
O
RO R
H
24
R
H
R
25 à 28
H
2
H
35
H
N
N
36
H
N
H
H
N
H
H
38
CH
3
CH
2
41
H
43
H
H
H
H
HH
H
48
H
Me
H
H
Me H
H
50
Me Me
Me
H
Me Me
Me
53
Les composés anioniques du tableau ont généralement
pour contre–cation soit : Li
+
, Na
+
, K
+
, ou MgX
+
.
Les composés cationiques du tableau ont
généralement pour contre–anion soit : Cl
—
, Br
—
, I
—
, ou
HSO
4—
.
1
/
3
100%