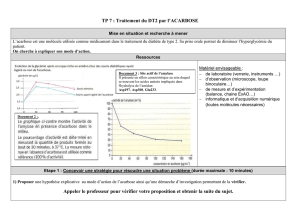
Examen session 1 du 04/01/2012, questions

UNIVERSITE PIERRE ET MARIE CURIE
LC204 2010-2011
EXAMEN DE CHIMIE ORGANIQUE
4 janvier 2012, session 1 - Durée de l’épreuve : 2 heures
L’épreuve comporte deux problèmes indépendants dont la durée de traitement est fournie à titre
indicatif. Ils seront traités sur deux copies différentes. L’usage des documents est interdit. Votre
copie doit être rédigée à l'encre bleue ou noire uniquement. Ne pas écrire vos réponses sur les
feuilles de l'énoncé.
Problème 1 (~1h)
On s’intéresse à la synthèse d’une molécule ayant des propriétés de cristal liquide.
1. Synthèse de l'intermediaire 4
On synthétise tout d’abord le dérivé aromatique 4 selon le schéma réactionnel suivant.
O2N NO2
I
H2N NH2
124
2.Réduction
SO3,H2SO41. HNO3/H2SO4
2. H2SO4dilué
3
SO3H
1. I-Cl
Le dérivé dinitré 3 est obtenu en trois étapes à partir du toluène 1.
1.1 Quel est l’intérêt du passage par le composé 2 ? Justifier.
1.2 Rappeler le mécanisme de la réaction de nitration (une seule étape est demandée).
1.3 Quelle est l’étape cinétiquement déterminante de ce mécanisme ? Justifiez.
La diamine 4 est ensuite obtenue via une étape d’iodation suivie par une réduction.
2. Synthèse de l'intermediaire 10
D’autre part, un deuxième intermédiaire aromatique 10 est obtenu en plusieurs étapes à partir du
triol 5, selon la séquence suivante :
O
HO OH OH
OMe O
RO OR OR
OMe
Br
solvant : CH3CN
Na2CO3,
57
6
O
R'O OR' OR'
OMe
SOCl2
7H2(40 bars)
Pd/C
8
1. KOH, MeOH/H2O
2. neutralisation 910
3.0 équivalents

2.1 Etape 5→ 7 :
2.1.1 Le premier pKa de 5 sera t-il inférieur ou supérieur à celui du phénol ? Justifiez.
2.1.2 Le composé 6 possède un centre stéréogène : déterminer sa configuration absolue.
2.1.3 Quel type de mécanisme permet la formation de 7 à partir des dérivés 5 et 6 ? Décrire ce
mécanisme en précisant le rôle du carbonate de sodium.
2.1.4 Développer la structure de 7 en précisant la nature du groupement R.
2.1.5 Le dérivé bromé 6 est-il chiral ?
2.2 Etape 7 →8:
2.2.1 Au cours de cette étape, le groupement R est transformé en R’ : quelle réaction est-elle
mise en œuvre au cours de cette conversion ?
2.2.2 Préciser le rôle du Pd/C.
2.2.3 Donner la structure explicitée de 8.
2.2.4 Pourquoi le noyau aromatique ne réagit-il pas dans ces conditions ?
2.3 Etape 8 → 9 :
2.3.1 Décrire le mécanisme qui conduit à la formation de 9.
2.3.2 Préciser la composition du milieu réactionnel avant l’étape 2 de neutralisation.
2.3.3. En déduire la quantité théorique de KOH qu’il faut utiliser pour convertir totalement 8 en
9.
2.4 Etape 9 → 10 :
Cette réaction conduit au composé 10 (qui contient un atome de chlore) ainsi qu’à un
dégagement gazeux de dioxyde de soufre et de chlorure d’hydrogène. En déduire la structure de
10.
3. Dernière étape
La troisième partie de la synthèse consiste en la condensation entree deux équivalents de 10 et
4, en présence de Na2CO3 dans l’acétone pour former 11 selon l’équation suivante :
I
N
HN
H
O O
R'O
R'O
OR' OR'
OR'
OR'
4, Na2CO3
acétone
10
11
3.1 Quels sont les autres produits qui se forment en même temps que le produit 11 ?
3.2 Écrire le mécanisme décrivant cette réaction.
3.3 Justifier l'intérêt de passer par l'intermédiaire 10 pour la synthèse de 11 (4 + 10 11) par
rapport aux transformations 8 + 4 11 et 9 + 4 11.

Problème 2 (~1h)
Le donépézil, présent sous la forme de chlorhydrate A, est un inhibiteur d’acétylcholinestérase. Il
est utilisé pour le traitement de la maladie d’Alzheimer, en particulier pour la perte de mémoire.
Nous allons nous intéresser ici à une synthèse récente de cet inhibiteur.
1. Synthèse de l’intermédiaire 4 :
1.1. Donner la structure du composé 2 obtenu après neutralisation. Quel est son mécanisme de
formation à partir de 1 ?
1.2. Donner la structure du composé 3. Quel est le mécanisme mis en jeu lors de son obtention ?
1.3. Quel(s) réactif(s) peut-on utiliser pour effectuer la transformation de 3 à 4 ?
2. Synthèse de l’intermédiaire 7 :
2.1. Donner la structure du composé 6.
2.2. Détailler le mécanisme réactionnel mis en jeu lors de la transformation de 6 en 7. Pourquoi est-
il nécessaire d'utiliser le trichlorure d’aluminium (AlCl3) en quantité stoechiométrique? Donner le
nom de cette transformation.
3. Synthèse du donépézil A :
3.1. La réaction de la cétone bicyclique 7 avec l’aminoaldéhyde 4 en présence de soude conduit à
un intermédiaire, qui peut subir une déshydration en milieu acide pour fournir le composé 8.
Détailler le mécanisme de cette réaction et donner la structure du composé 8.
3.2. Comment s'appelle la première étape qui permet de transformer 8 en donépézil A1 ?
1 Le traitement avec HCl permet juste d’isoler le donépézil sous forme de chlorhydrate.
1
/
3
100%