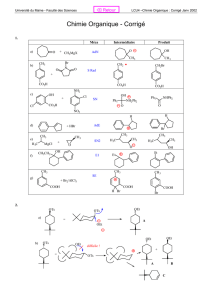
HO CHO OH OH OH OH

UE CHI242
EXAMEN CHIMIE ORGANIQUE
25 mai 2010, première session
Durée : 2 h, documents de spectroscopie autorisés, réponse sur la copie.
Exercice I
Soit la molécule de glucose sous forme ouverte A :
1 - Dans les cases correspondantes, indiquer la stéréochimie de tous les carbones
stéréogènes :
HO CHO
OH
OH
OH
OH
2 – Spontanément la forme ouverte A de glucose cyclise pour donner la forme B.
HO CHO
OH
OH
OH
OH
A
O OH
OH
HO OH
HO
B
a – A quelle classe de composé appartient la forme cyclique B ?
b – Sur le dessin suivant, entourer les atomes impliqués dans la réaction qui
permettent la réaction de cyclisation :
HO OH
OH
OH
OH O
H
c – Proposer un mécanisme permettant de passer de la forme ouverte A à la forme
fermée B en symbolisant la fonction aldéhyde par R
1
-CHO et l’alcool par R
2
-OH.

Exercice II
On souhaite synthétiser le composé G à partir du produit A. Pour ce faire six étapes sont
nécessaires.
O
G
OEtO
A
1 – Dans une première étape on souhaite réduire la fonction ester en alcool primaire B.
OEtO
A
B
a – Quel réactif permet cette transformation :
b – Donner la structure de l’alcool B :
2 – L’alcool B est transformé en composé C, qui lui-même est transformé en composé E
suivant la séquence suivante :
Br
BMg
Et
2
OD
C
1) CO
2
2) H
+
, H
2
OE
a – Donner la structure du composé D :
b – Ecrire le mécanisme de formation de E à partir de D (qui sera symbolisé par
RCH
2
Br. Donner la structure de E :
Mécanisme :
Structure de E :

3 – Le composé E est finalement transformé en produit G selon la séquence suivante :
EAlCl3
F
SOCl2Cl
O O
G
a – Ecrire le mécanisme de formation de G partir de F :
b – On pourrait imaginer la formation d’un composé G’ à côté de G. Donner la
structure de G’ et expliquer pourquoi ce produit n’est pas observé :
Structure de G’ :
Justification :
Exercice III
On souhaite préparer le composé F en 5 étapes à partir de l’alcène A :
H
3
C
H
3
C
H
Br
Mg
Et
2
OB
A
O
CH
3
1)
2) H
3
O
+
CCrO
3
Pyridine
H
3
C
H
3
C
H
DCH
3
O
ECrO
3
Pyridine F
1) BH
3
2) H
2
O
2,
OH
-

1 – Donner la formule de B :
2 – Ecrire le mécanisme de formation de C à partir de B. Donner la structure de C :
Mécanisme :
Structure de C :
3 – Quelles sont les valeurs attendues des longueurs d’onde caractéristiques du spectre
infrarouge du composé D ?
4 – Ecrire le mécanisme de formation de E à partir de D. Donner la structure de E :
Mécanisme :
Structure de E :
5 – Le composé F peut également être obtenu par ozonolyse en milieu réducteur (O
3
puis Zn)
du Terpinène :
Terpinène
1) O
3
2) Zn F (C
8
H
14
O
2
) + F'

Donner la structure des produits F et F’ :
Structure de F :
Structure de F’ :
Exercice IV
On considère les réactions de substitution nucléophile suivantes :
Processus A :
CHCH
3
Configuration S
+ NaI 20°C
CHCH
3
Mélange racémique
+ NaCl
Composé A
Cl I
Processus B :
H
2
CCHD
Configuration S
+ NaI 20°C
Cl H
2
CCHD
Configuration R
+ NaCl
I
Composé B
Remarque : Dans la séquence Cahn-Ingold et Prelog, l’isotope deutérium D de l’hydrogène
est prioritaire devant H.
1 - En utilisant l’échelle suivante, dessiner le spectre RMN
1
H théorique du composé A :
ppm
2 14
5
6
7
89 O3
 6
6
 7
7
1
/
7
100%