UE CHI242 EXAMEN CHIMIE ORGANIQUE Mai 2011, première

UE CHI242
EXAMEN CHIMIE ORGANIQUE
Mai 2011, première session, correction
Durée : 2 h, documents de spectroscopie autorisés, réponse sur la copie.
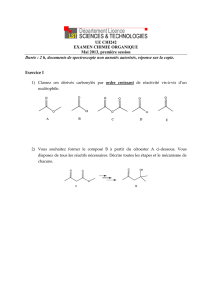
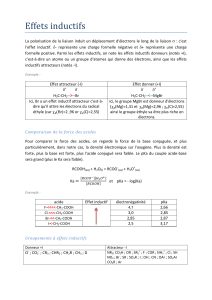
Exercice I
Soit les réactions suivantes permettant la synthèse du propan-1-ol :
H
3
C CH
2
CH
2
OH
a
H
3
C CH
2
CO
HH
3
C CH
2
CO
OCH
3
1
H
3
C CH
2
CH
2
OCH
3
O
H
3
C MgBr
H
3
C CH
2
MgBr
b
c
e
d
3
4
5
6
2
1) - Réaction (a) :
Proposer deux réactifs qui permettent d’obtenir le composé 1 à partir du
composé 2 ?
NaBH
4
LiAlH
4
2) - Réaction (b) :
Les deux réactifs précédemment cités (dans la question 1) sont ils efficaces
pour effectuer la réaction (b) ? Justifier votre réponse.
Seul LiAlH
4
permet la réduction des esters, NaBH
4
ne sera pas efficace sur le composé 3.
3) - Réaction (c) :
a – Quel réactif permet d’effectuer la réaction (c) ?
Il s’agit d’une réaction de saponification d’ester donc NaOH (source d’OH
-
) permettra de
réaliser cette réaction. On peut également envisager la réaction inverse de l’estérification en
utilisant de l’eau mais cette solution sera moins efficace que la précédente. On acceptera
également comme réponse LiAlH4 et RMgX, bien qu’expérimentalement ces méthodes ne
soient pas des méthodes de choix pour la synthèse de 1 à partir de 4.
b – Donner le mécanisme de cette réaction :
C
O
OR
C
O OH
OR
OH
-
+
C
O
OH
+ RO
-
C
O
O
+ ROH

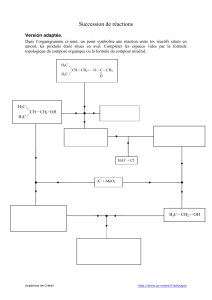
4) - Réaction (d) :
a – Quelle réaction permet l’obtention du composé 5 ? Préciser également le
solvant généralement utilisé pour effectuer cette réaction.
CH
3
-CH
2
-Br + Mg → CH
3
-CH
2
-Mg-Br
La réaction s’effectue dans un éther par exemple du THF ou du diéthylether
b - Quel composé organique doit réagir avec le produit 5 pour mener au composé
1 ?
HC
O
H
c – Préciser le mécanisme de la réaction (d) ?
Cδ+
O
H H
δ−
H2
CMg Br
δ−
δ−
δ+
+
C
O
H
C2H5
H
+
HOH
δ+ δ+
δ−
MgBr
C
OH
H
C2H5
H
MgBrOH +
1/2 MgBr
2
+ 1/2 Mg(OH)
2
H3C
5) - Réaction e :
Quel composé organique doit réagir avec le produit 6 pour mener au composé 1 ?
C C
O
H H
H H
6) – En utilisant l’échelle suivante, dessiner le spectre RMN1H théorique du composé
3 :
1 triplet (121) intégrant pour 3 à 1,02 ppm
1 quadruplet (1331) intégrant pour 2 à 2,2 ppm
1 singulet intégrant pour 3 à 3,7 ppm.

Exercice II
On considère la réaction de solvolyse suivante :
R-X R-OCH
2
CH
3
HX
k
é
t
h
a
n
o
l
+
X = OTs ou Br ; R = Me ou
t
Bu
a-Quel est le nom général de la réaction ?
Substitution nucléophile
b-Pour chacun des radicaux R, préciser si la réaction se déroule selon un
mécanisme unimoléculaire ou bimoléculaire
R Mécanisme
Me SN2
t
Bu SN1
Justifier brièvement
Dans le premier cas on ne peut pas former de carbocation stable lors du départ du nucléophile
⇒SN2. Dans le deuxième cas le carbocation formé est stable ⇒ SN1.
c- Dessiner la structure du groupement tosylate
S
O
O
O
d – Entre Br
-
et TsO
-
quel est le meilleur nucléofuge ? Expliquer.
Un nucléofuge est d’autant meilleur qu’il génère une espèce stable. Dans le cas du tosylate, on
peut envisager de stabiliser la charge négative par mésomérie donc il s’agit d’une espèce très
stable donc très nucléofuge, plus que le Br
-
qui lui ne subit pas d’effet mésomère.
Exercice III
1 - Pour chacune des réactions, déterminer le (ou les) produit(s) formé(s) en précisant à quel
type de mécanisme (E, SN,…) elle appartient.

Réaction Nom
général
de la
réactio
n
1
N
Cl
Et-NH
2
+
SN
2
O
LiAlH
4
+
OH
AN
3
Cl2, AlCl3
OMe OMe
Cl
SE
4
HBr
+
Br
AE
5
OH
H
+
, ∆
E1
2 – Préciser les mécanismes :
a – de la réaction
4
:

H
+
Br
Br
b – de la réaction
5
:
OH H+OH
2
H
+ H+
3- Dans le cas de la réaction
3
,
a-écrire les formes limites du composé de départ (méthoxybenzene)
OMe OMe OMe OMe
++ - + -
b-La réaction sera-t-elle plus ou moins rapide qu’avec le benzène ?
Plus rapide car le méthoxy enrichit électroniquement le noyau aromatique.
c-Qu’elle est l’orientation engendrée du groupement méthoxy vis-à-vis d’un
électrophile ?
Comme le montrent les structures limites le groupement méthoxy est ortho/para directeur
puisqu’il enrichit en électrons ces 2 positions.
 6
6
1
/
6
100%