Occlusions sur carcinose péritonéale : prise en charge

Mini-revue
La prise en charge
des occlusions
sur carcinose péritonéale
Guillemette Laval
1
, Nicolas Beziaud
1
, Emmanuel Germain
2
,
Christine Rebischung
3
, Catherine Arvieux
4
1
Médecins en soins palliatifs, Unité de Recherche et de Soutien en Soins Palliatifs,
CHU, BP 217, 38043 Grenoble cedex 9
2
Médecin gastroentérologue, Service d’Hépato-Gastroentérologie, CHU, BP 217,
38043 Grenoble cedex 9
3
Médecin oncologue médical, Hôpital de jour d’Onco-Hématologie, CHU, BP 217,
38043 Grenoble cedex 9
4
Professeur, chirurgien digestif, Service de Chirurgie Digestive et de l’Urgence, CHU,
BP 217, 38043 Grenoble cedex 9
La carcinose péritonéale témoigne d’une maladie néoplasique évo-
luée et est habituellement associée à une faible survie. Le traitement
antitumoral spécifique, lorsqu’il est efficace et qu’il peut être sup-
porté par le malade, est le traitement le plus bénéfique à moyen
terme sur les symptômes. Dans le cas contraire, il faut avoir recours
à un unique traitement symptomatique palliatif et les travaux publiés
démontrent qu’il est possible de contrôler efficacement les symptô-
mes d’occlusion sans avoir recours à une sonde nasogastrique ou à
un traitement désobstructif chirurgical. La prise en charge du patient
doit être multidisciplinaire, intégrant thérapeutiques médicamenteu-
ses, endoscopique et chirurgicale qui permettent le plus souvent un
soulagement des symptômes. Le traitement médicamenteux asso-
ciant corticoïdes, antisécrétoires, antiémétiques et antalgiques, per-
met l’amélioration des nausées/vomissements et de la douleur avec
ou sans levée d’obstacle. En cas de premier épisode occlusif sur
carcinose, pour le traitement antisécrétoire, nous préconisons l’utili-
sation des anticholinergiques atropiniques en première intention
comparativement aux analogues de la somatostatine (essentielle-
ment l’ocréotide) que nous réservons aux vomissements rebelles ou
pour les syndromes subocclusifs à répétition. En cas de sténose
unique et accessible par voie endoscopique, les traitements désobs-
tructifs par prothèses métalliques expansibles apportent un net
bénéfice en termes de qualité de vie, de répercussion psychologique
et en termes de coût-efficacité par rapport à une gastrostomie. Mais
en cas d’impossibilité de ceux-ci et de symptômes et notamment de
vomissements rebelles malgré le traitement médicamenteux, une
gastrostomie de décharge est justifiée et il faut savoir ne pas attendre
pour la réaliser quand elle devient nécessaire. Pour conclure, nous
proposons une stratégie thérapeutique médicamenteuse pour
l’occlusion intestinale maligne non résécable que nous appliquons
avec de bons résultats cliniques sur le CHU de Grenoble.
Mots clés : occlusion intestinale, carcinose péritonéale, endoprothèse,
gastrostomie de décharge, hyoscine butylbromide, octréotide
Hépato-Gastro, vol. 14, n°6, novembre-décembre 2007
Tirés à part : G. Laval
465
doi: 10.1684/hpg.2007.0165
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

L’occlusion intestinale sur carcinose périto-
néale est une complication fréquente des
pathologies cancéreuses évoluées. Bien sou-
vent, seul un traitement symptomatique plurimodal et
palliatif permettra le soulagement du patient avec ou
sans levée du syndrome occlusif, les traitements curatifs
par chirurgie et chimiothérapie restant exceptionnels.
Nous insisterons tout particulièrement sur les progrès
concernant les différents traitements médicamenteux
maintenant mieux connus, sur les traitements désobs-
tructifs endoscopiques avec l’usage des prothèses
métalliques extensibles (stents) quand possibles et sur
l’intérêt de la gastrostomie de décharge en cas d’échec
de ces traitements.
Rappels épidémiologiques
et physiopathologiques
La carcinose péritonéale, définie comme une dissémi-
nation et une implantation de cellules tumorales dans la
cavité péritonéale, résulte le plus souvent d’une tumeur
primitive péritonéale (mésothéliome...) ou d’une exten-
sion tumorale aux viscères intra-abdominaux (ovaire,
côlon, estomac, pancréas, voies biliaires, etc.). Une de
ses conséquences en est le syndrome occlusif, essen-
tiellement par compression extrinsèque avec sténose
digestive, le plus souvent multiple.
Les études [1] montrent que la fréquence de l’occlusion
intestinale peut s’élever jusqu’à 42 % dans le cancer
de l’ovaire et 24 % dans le cancer colorectal. Chez les
patients en soins palliatifs, la fréquence varie selon les
centres [2] ; au CHU de Grenoble, en 2006, 15 % des
patients pour lesquels un médecin de l’équipe mobile a
été sollicité pour avis présentaient une occlusion intes-
tinale.
En pratique, une fois le diagnostic d’occlusion fonction-
nelle éliminé (principalement iléus paralytique et cons-
tipation sévère [cf. tableau 1]), deux cas de figure se
présentent : soit il existe une carcinose péritonéale
quasi certaine du fait de l’évolution de la maladie
et/ou des signes scannographiques, soit il existe une
éventualité de lésion tumorale curable (récidive ou
métastase unique) ou plus souvent une lésion bénigne,
les deux plus fréquentes étant l’occlusion sur brides et le
grêle radique. En cas de suspicion de cause curable, la
cœlioscopie ou la laparotomie exploratrice s’impose.
En cas de carcinose, cette chirurgie est le plus souvent
délétère et c’est le traitement médical qui doit être
proposé en première intention.
Rappels diagnostiques
Le diagnostic de l’occlusion intestinale est essentielle-
ment clinique et radiologique (tableau 2). La radiogra-
phie abdominale sans préparation (ASP), debout et de
face, porte le diagnostic d’occlusion. L’échographie
abdominale permet surtout de mettre en évidence une
ascite et d’effectuer une ponction échoguidée à la
recherche de cellules malignes. Le scanner abdomino-
pelvien est l’examen paraclinique de choix. Il permet
de confirmer le diagnostic de tumeur inextirpable,
d’ascite ou de carcinose en cas de lésions étendues
(tableau 3). Il permet également d’évaluer le retentisse-
ment et la gravité de la carcinose sur l’importance de la
dilatation du colon ou sur l’existence de signes de
souffrance des parois digestives.
Tableau 1.Causes d’obstruction intestinale
dans le cancer avancé.
- Carcinose péritonéale
- Occlusion sur bride
- Occlusion par lésion radique
- Trouble de la motricité intestinale par iléus
fonctionnel favorisé par :
•infiltration maligne du mésentère ou des couches musculaires
intestinales ou des nerfs du plexus cœliaque,
•neuropathie paranéoplasique (cancer du poumon),
•troubles métaboliques (hypokaliémie, hypercalcémie,
acidose, insuffisance rénale), troubles endocriniens
(hypothyroïdie, hyperparathyroïdie...),
•médicaments (opiacés, psychotropes, etc.),
•affections satellites (foyer septique intrapéritonéal,
pancréatite aiguë, colique néphrétique...).
- Cas particulier de la constipation qui peut entraîner un
état subocclusif, voire une véritable occlusion (fécalome)
favorisée en soins palliatifs par les opioïdes, les psychotropes, la
scopolamine, l’alitement prolongé et les apports hydriques et
alimentaires insuffisants. Son traitement préventif est capital.
Tableau 2.Signes cliniques et radiologiques simples
en faveur de l’occlusion intestinale.
Trois signes sur six sont en principe nécessaires au diagnostic
d’occlusion :
-douleurs coliques abdominales;
-au moins 2 vomissements par jour;
-météorisme abdominal;
-arrêt des gaz depuis 12 h ou plus;
-absence de matières fécales depuis 72 h ou plus (le TR élimine
le fécalome);
-niveaux hydroaériques ou absence d’aérocolie à l’ASP.
Tableau 3.Signes évocateurs de carcinose péritonéale
en TDM.
-Masse tumorale envahissant les organes de voisinage et/ou la
paroi,
-Nodules péritonéaux,
-Épaississements épiploïques,
-Sténoses multiples de l’intestin grêle,
-Métastases hépatiques,
-Ascite.
Mini-revue
Hépato-Gastro, vol. 14, n°6, novembre-décembre 2007
466
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

Dans cette étape diagnostique, l’occlusion peut être
associée (ou précédée) d’autres symptômes liés à la
carcinose, en particulier une oligoanurie par compres-
sion des voies urinaires ou un ictère.
Traitements chirurgicaux,
techniques endoscopiques
et sonde naso-gastrique
La chirurgie
La chirurgie à visée curative, avec la réduction du
volume tumoral associée à une chimio-hyperthermie
intrapéritonéale (CHIP), reste exceptionnelle [3]. Pour
la grande majorité, l’espérance de vie est faible avec
de nombreux facteurs de mauvais pronostic contre-
indiquant un traitement chirurgical palliatif [4]
(tableau 4). Outre les effets délétères directs de la
laparotomie et de l’anesthésie, les suites chirurgicales
sont à haut risque de complications altérant alors
considérablement la qualité de vie [5]. Ainsi, dans un
travail portant sur 61 patients opérés avec un diagnos-
tic de carcinose péritonéale [6], nous avions séparé les
patients en quatre groupes selon le geste réalisé. Chez
ceux pour lesquels aucun geste spécifique n’avait pu
être réalisé (laparotomie « aller–retour »), la mortalité
postopératoire à un mois atteignait 60 %. Les interven-
tions palliatives de type dérivation interne se compli-
quaient de fistules ou d’abcès dans 30 % des cas,
responsables de réinterventions itératives et d’un incon-
fort majeur. Les patients ayant eu des stomies avaient
des suites plus simples mais celles-ci constituaient une
gêne importante pour eux et leur famille. Enfin, un
dernier groupe de patients avait eu une gastrotomie de
décharge, avec un taux de complications faible et une
bonne qualité de vie. Ces données ont été confirmées
par d’autres travaux [7, 8]. Nous avons donc opté
pour la réalisation de la gastrostomie de décharge
quasi systématique devant une carcinose découverte
en cours de laparotomie exploratrice ou lors d’une
« mini-laparotomie » pour des vomissements rebelles
par occlusion résistante au traitement médical.
Les traitements désobstructifs
endoscopiques
Les traitements désobstructifs par prothèses métalliques
expansibles (PME) sont en plein développement du fait
des progrès techniques et anesthésiques. Ils sont posés
par voie endoscopique, radiologique ou mixte. Les
prothèses mises par voie haute sont indiquées dans le
cas de sténose unifocale, accessible, c’est-à-dire
antrale, duodénale ou jéjunale proximale. Les prothè-
ses mises par voie basse, rectale ou colique gauche,
viennent supplanter le classique traitement par laser
des cancers rectosigmoïdiens. La pose de PME devient
également possible au niveau du côlon ascendant, de
l’angle droit et du côlon transverse [9]. Une récente
étude prospective multicentrique française auprès de
45 patients a montré l’efficacité du traitement en
urgence par PEM, de sténoses néoplasiques rectales
ou coliques gauches permettant la réalisation différée
d’une chirurgie réglée ou d’une radiothérapie préopé-
ratoire dans 49 % des cas et un traitement palliatif
fonctionnel efficace pour presque tous les autres
patients (44 %) [10]. Une revue de la littérature sur leur
utilisation dans l’occlusion intestinale [11] relève des
taux de succès fonctionnels (manger sans vomissement
pour les prothèses hautes, levée de l’occlusion pour les
prothèses basses) très importants (entre 63 et 100 %
selon les études) avec une très faible mortalité induite
par la pose. La toute récente étude de Gionannini et al.
[12] auprès de 178 patients ayant bénéficié d’une
PME œsophagienne, duodénale ou colique montre
qu’il s’agit d’une technique simple, sûre et efficace
dans 95 % des cas pour traiter l’obstacle tumoral. Les
auteurs notent un risque plus grand de migration pour
les prothèses coliques et plus d’obstruction pour les
prothèses duodénales. Enfin, plusieurs travaux compa-
rant colostomies de décharge et endoprothèses coli-
ques confirment l’efficacité supérieure du traitement
endoscopique en termes de qualité de vie, de réper-
cussion psychologique et en termes de coût-efficacité
[13, 14].
La gastrostomie de décharge
La pose d’une gastrostomie de décharge par voie
endoscopique est habituellement réalisée par voie per-
cutanée transgastrique endoscopique avec un éventuel
guidage radiologique [15]. Cette méthode de choix est
efficace sur les vomissements rebelles dans la majorité
des cas au prix d’un faible taux de complications
techniques [7]. Selon l’état du patient et l’habitude des
équipes, elle peut être réalisée par voie chirurgicale
(gastrostomie tunnellisée selon Witzel [16]), d’autant
Tableau 4.Facteurs de mauvais pronostic contre-indiquant
un traitement chirurgical palliatif.
-Grand âge,
-Mauvais état général (OMS 3 ou 4),
-Mauvais état nutritionnel (albuminémie < 25 g/L),
-Extension de la maladie néoplasique : carcinose péritonéale
diffuse, ascite, masse palpable, métastases à distance, obstacles
multiples sur le grêle, etc.
-Antécédents de radiothérapie abdominale ou pelvienne ou de
chimiothérapie combinée,
-Occlusion du grêle plutôt qu’occlusion colique,
-Intervention en urgence,
-Tumeur primitive gastrique, pancréatico-biliaire ou
gynécologique.
Hépato-Gastro, vol. 14, n°6, novembre-décembre 2007 467
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

plus en cas d’ascite, de masses pariétales sur carcinose
évoluée ou encore en cas d’antécédent de gastrecto-
mie partielle ou de tout autre remaniement interne et
adhérences. La plupart du temps, la gastrostomie de
décharge est très bien tolérée. Aussi, il nous paraît
important de rassurer les patients sur cette technique et
de savoir ne pas attendre pour la réaliser quand elle
devient nécessaire. Les patientes en occlusion sur car-
cinose par cancer de l’ovaire et encore traitées par
chimiothérapie illustrent bien cette réalité [17]. L’étude
prospective [18, 19] que nous avons menée sur 4 ans
au CHU de Grenoble auprès de 75 patients recevant
ou non une chimiothérapie et présentant un syndrome
occlusif non résécable sur carcinose (80 épisodes
occlusifs car 5 patients ont eu 2 épisodes occlusifs à
distance l’un de l’autre) montre que nous réalisons
tardivement ce geste. Dix patients ont eu recours à cette
technique après échec des traitements médicamenteux
symptomatiques dont 6 pour cancer de l’ovaire. La
médiane du délai pour sa réalisation après l’échec
était de 17 jours (12 à 35 jours). La médiane de durée
de vie après l’intervention était de 13 jours (de 6 à
125 jours) soit proche de celle de 17 jours dans une
étude comparable auprès de 51 patients [7]. Cela
souligne certes le mauvais pronostic des patients consi-
dérés, mais aussi nos difficultés à poser l’indication de
la gastrostomie et à l’organiser.
L’utilisation de la sonde nasogastrique
L’aspiration nasogastrique soulage partiellement des
symptômes pénibles de l’occlusion. Elle n’est plus sys-
tématique depuis le développement des traitements
médicamenteux antisécrétoires (essentiellement butyl-
bromure de scopolamine et octréotide) qui, en associa-
tion ou non à un antiémétique, permettent le plus
souvent un contrôle des vomissements. Le groupe
d’experts de l’Association européenne de soins pallia-
tifs (EAPC) [20] recommande son utilisation en cas de
vomissement invalidant en début de traitement seule-
ment dans l’attente de l’efficacité des médicaments ou
en cas d’échec de ceux-ci et d’impossibilité de pose
d’endoprothèse ou de réalisation d’une gastrostomie
de décharge. Une sonde naso-gastrique (SNG), sauf
exception, ne devrait plus être utilisée au-delà de
quelques jours compte tenu de l’inconfort important
qu’elle représente et de son caractère invasif : immobi-
lisation du patient, douleurs et infections nasales et
pharyngées, sinusite, ulcération de l’aide du nez, éro-
sion œsophagienne, pneumopathie d’inhalation, etc.
En pratique, il faut aussi savoir le retirer rapidement
même chez un patient qui n’a pas repris de transit.
Compte tenu du volume sécrétoire gastrique habituel,
elle n’a pas de raison d’être si elle ramène moins de un
litre/24 h [19].
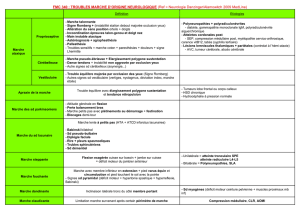
Le traitement pharmacologique
Il s’appuie sur les recommandations de l’EAPC, confir-
mées par la récente revue de la littérature de Merca-
dante et al. [21] qui souligne l’intérêt d’une approche
pharmacologique multimodale permettant une syner-
gie entre les médicaments utilisés. Le traitement associe
corticoïdes, antisécrétoires, antiémétiques et antalgi-
ques. La réhydratation parentérale intraveineuse ou
sous-cutanée, avec correction d’éventuels troubles
hydroélectrolytiques, est systématique en phase aiguë.
Les corticoïdes
L’étude multicentrique randomisée en double aveugle
que nous avons réalisée il y a quelques années [22]
comparait la méthylprednisolone (1 ou 4 mg/kg/j,
3 jours) au placebo chez 40 patients cancéreux en
occlusion intestinale non opérable (avec ou sans carci-
nose) et sans SNG. Elle retrouvait deux fois plus
(p= 0,047) de levée d’occlusion sous stéroïdes que
sous placebo, sans toutefois pouvoir préciser
l’influence de la posologie sur le résultat obtenu.
L’actuelle insuffisance de travaux sur des populations
homogènes (type de cancer, carcinose ou non...) et en
nombre suffisant (> 100 patients) rend difficile les
conclusions et la question reste débattue. Dans notre
expérience, il semble que les corticoïdes sont d’autant
plus efficaces sur la levée d’occlusion que le patient
n’en recevait pas au préalable comme si l’effet
antiœdémateux libérant la lumière intestinale était
maximal lors d’une première utilisation. L’étude sur le
CHU de Grenoble [18, 19] montre bien, en effet, dans
l’étape I du protocole alors utilisé, que 20 des 25
(80 %) levées d’occlusions sous corticoïdes l’étaient
chez des patients qui n’en recevaient pas auparavant,
contre 30 sur 55 (55 %) patients sans levée d’occlusion
et qui étaient déjà sous corticoïdes. Cette différence est
significative (p= 0,03). Cela nous invite de manière
générale à plutôt utiliser les corticoïdes en cure courte
de quelques jours seulement, et à les renouveler si
besoin. Ces résultats initiaux nous paraissent toutefois
très importants pour le confort des patients. L’action
antiémétique, coanalgésique et stimulante des corticoï-
des est également intéressante.
Les antisécrétoires : anticholinergiques,
analogues de la somatostatine
et inhibiteurs de la pompe à protons
Des études comparatives [23-25] entre l’antisécrétoire
anticholinergique, la hyoscine butylbromide, encore
appelée butylbromure de scopolamine (Scoburen
®
)(à
bien différencier de la scopolamine que nous ne recom-
mandons plus dans cette indication car trop sédative)
et l’antisécrétoire analogue de la somatostatine,
Mini-revue
Hépato-Gastro, vol. 14, n°6, novembre-décembre 2007
468
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

l’octréotide (Sandostatine
®
) ont été réalisées. Elles
montrent leur efficacité sur les symptômes de l’occlusion
avec la supériorité de l’octréotide sur la réduction du
volume sécrétoire gastro-intestinal et la rapidité
d’action (48 h dans l’étude de Ripamonti et al. [26]).
Cependant, l’efficacité certaine et souvent suffisante du
butylbromure de scopolamine sur les symptômes liés à
l’occlusion d’une part, et son faible coût d’autre part
(5,34 5TTC pour 120 mg par jour de Scoburen
®
contre 80,38 5pour 600 lg par jour de
Sandostatine
®
-tarif Vidal 2007) nous le font proposer
en première intention (étape I, tableau 5). C’est seule-
ment en cas d’échec sur les vomissements que nous le
remplaçons par de l’octréotide (étape II, tableau 5).
Ainsi, dans notre étude [18], 50 des 80 épisodes
occlusifs avaient en effet été contrôlés par l’étape I hors
octréotide avec 25 contrôles des symptômes sans levée
d’occlusion et 25 levées d’occlusion. Parmi les 25
autres patients mis alors sous octréotide (5 patients
étaient sortis d’étude), 11 ont vu leur état s’améliorer
dont 4 avec levée d’occlusion soulignant bien l’effica-
cité de ce dernier. En revanche, dans le cas d’épisodes
subocclusifs à répétition chez un patient qui peut
encore s’alimenter et qui vomit régulièrement, nous
préférerons utiliser d’emblée l’octréotide afin d’optimi-
ser notre efficacité sur les vomissements et retarder le
passage en occlusion constituée. L’utilisation de
l’octréotide en première intention peut également être
proposée dans les occlusions d’origine haute du fait de
l’importance du volume des sécrétions. En effet, Ripa-
monti [1, 26] et Mercadante [21, 27] insistent beau-
coup sur les différents modes d’action de l’octréotide
qui, à la fois, diminue les sécrétions intestinales, favo-
rise l’absorption d’eau et d’électrolytes et réduit le
péristaltisme intestinal permettant ainsi de rompre le
cercle vicieux « sécrétion-distension-hypertonie intesti-
nale ». Sa puissante action inhibitrice de la motricité
intestinale n’empêche pas, comme le montrent les étu-
des, la reprise du transit intestinal.
La prise de Scoburen
®
s’accompagne très souvent de
sécheresse buccale (importance des bains de bouche)
et plus rarement de somnolence et parfois de tachycar-
die. Son administration se fait par voie parentérale,
sous-cutanée ou intraveineuse aux posologies recom-
mandées (tableau 5). Il est disponible en ville et à
l’hôpital.
La prise de sandostatine s’accompagne plus rarement
de sensation de sécheresse de bouche et de somno-
lence. Son administration se fait par voie sous-cutanée
en discontinu toutes les 8 h (ou 12 h), ou en continu
(SC ou IV) sur 24 h au pousse-seringue électrique aux
posologies recommandées (tableau 5). La gêne transi-
toire au point d’injection sous-cutanée (possible anes-
thésie locale par crème Emla
®
) disparaît en cas
d’administration continue. Une forme LP existe pour les
traitements au long cours (Sandostatine
®
30 mg LP, une
injection IM/mois, coût journalier 49 5-Vidal 2007).
Elle n’est active qu’en 7 jours d’où la nécessité de
maintenir la forme LI pendant une semaine. Sa déli-
vrance se fait à l’hôpital et en officine de ville après une
prescription initiale hospitalière.
À l’appui de nombreux travaux, l’analogue de la
somatostatine recommandé en France dans cette indi-
cation bien que hors AMM, est l’octréotide (Sandosta-
tine
®
) [28, 29]. Cependant, d’autres dérivés de la
somatostatine existent avec la vapréotide (une injection
par semaine) qui a déjà fait l’objet de travaux mais
dont on manque de données comparatives en soins
palliatifs [30] et le lanréotide en cours d’étude dans
cette indication avec la Somatuline
®
30 mg, une injec-
tion IM tous les 10 à 14 jours, coût journalier 64 5ou
45 5- Vidal 2007).
L’association analogue de la somatostatine et anticho-
linergique ne paraît pas présenter grand intérêt. Elle
n’est pas spécialement recommandée ni contre-
indiquée [20].
Les inhibiteurs de la pompe à protons à forte posologie
peuvent être proposés dans les vomissements par
occlusion haute [29]. Nous n’en avons pas l’expé-
rience.
Les antiémétiques
Aucune étude comparative ne permet de dire quel
antiémétique choisir en cas de syndrome occlusif. Il est
certain que le métoclopramide (Primperan
®
) ne devrait
pas être utilisé dans les occlusions hautes de par son
action prokinétique. Les recommandations internatio-
nales retiennent essentiellement l’halopéridol (Haldol
®
)
ou la chlorpromazine (Largactil
®
)(tableau 5), seul ou
associé à un antihistaminique (cyclizine ou dimenhy-
drate non commercialisé en France), ou à un sétron.
Haldol
®
est moins sédatif que Largactil
®
. Ce dernier est
mieux supporté lors d’une administration continue au
pousse-seringue électrique, par voie sous-cutanée ou
intraveineuse. La voie orale ou sublinguale peut être
utilisée (gouttes). Nous recommandons de débuter aux
plus petites posologies. Les anti 5HT3 (ondansétron,
granisétron, tropisétron, dolasétron, etc.) ne sont pas
des antiémétiques habituellement recommandés en
première intention du fait de leur mécanisme d’action
essentiellement périphérique bloquant la sérotonine
libérée par la muqueuse intestinale sous l’action de
facteurs extérieurs cytotoxiques essentiellement induits
par la chimiothérapie et la radiothérapie doivent
cependant être essayées.
Les laxatifs
Les laxatifs ont tout leur intérêt associés ou non aux
lavements dans les états subocclusifs. Mercadante [31]
Hépato-Gastro, vol. 14, n°6, novembre-décembre 2007 469
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%