Activité expérimentale N°2 (C18) Selon leur classe, les alcools (R

Activité expérimentale N°2 (C18)
Selon leur classe, les alcools (R-OH, R est un groupe d’atomes constitué de C et de H) sont oxydés par une solution
de permanganate de potassium acidifiée par de l’acide sulfurique (K+(aq) + MnO4-(aq)). Les ions permanganate MnO4-(aq)
(violets) se réduisent en ions manganèse (II) Mn2+(aq) (incolores).
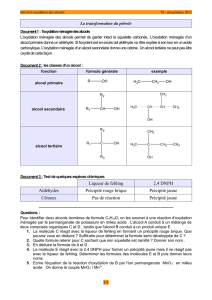
Les trois alcools utilisés pendant ce TP sont de formules brutes C4H10O.
a) Comment s’appellent des molécules ayant même formule brute, mais avec un agencement d’atomes différent ?
…………………………………………………………………………………………………………………………………………………………………………………………………………………
b) A partir de la formule brute C4H10O, complète le tableau suivant :
Classe de l’alcool
Formule semi-développée et topologique
Nom de l’alcool
(I)
(II)
(III)
1- Protocole expérimental de l’oxydation ménagée des alcools (I), (II) et (III) avec l’oxydant en défaut :
Dans trois tubes à essai marqués I, II et III, verse environ 1 mL d’alcool primaire, 1 mL d’alcool secondaire et 1 mL
d’alcool tertiaire. Bouche.
Ajoute dans chaque tube à essai environ 3 mL d'acide sulfurique à 6 mol∙L-1.
Ajoute 3 mL d'une solution de permanganate de potassium à 0,2 mol∙L-1.
Bouche et agite en retournant 1 seule fois.
a) Au bout de quelques minutes, qu’observes-tu et qu’interprètes-tu :
- pour l’alcool (I) ? ……………………………………………………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………………………………………………………………………………………
- pour l’alcool (II) ? ……………………………………………………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………………………………………………………………………………………
- pour l’alcool (III) ? …………………………………………………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………………………………………………………………………………………
Sous la hotte, ajoute 1 mL de cyclohexane pour extraire la phase organique contenant les produits de l’oxydation
ménagée des alcools. Bouche, agite puis laisse reposer.
b) Où se trouve la phase organique ? Justifie avec les densités : d(eau) = 1 ; d(cyclohexane) = 0,78. Comment le
démontrer expérimentalement ? ………………………………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………………………………………………………………………………………

2- Caractérisation du produit d’oxydation ménagée des alcools (I) et (II) avec l’oxydant en défaut :
Avec la phase supérieure des tubes I et II, fais les tests de la 2,4-DNPH et de la liqueur de Fehling pour
caractériser les produits de l’oxydation ménagée des alcools.
a) Observe et conclus pour le test à la 2,4-DNPH.
Alcool (I) : ……………………………………………………………………………………………………………………………………………………………………………………………
Alcool (II) : ……………………………………………………………………………………………………………………………………………………………………………………………
b) Observe et conclus pour le test à la liqueur de Fehling.
Alcool (I) : ……………………………………………………………………………………………………………………………………………………………………………………………
Alcool (II) : ……………………………………………………………………………………………………………………………………………………………………………………………
c) Pour récapituler l’oxydation ménagée des alcools (I) et (II), complète le tableau suivant.
REACTIFS
Résultat
des tests du produit
(positif ou négatif)
PRODUIT FORME
(avec oxydant en défaut)
Alcool (réducteur)
Oxydant
(en défaut)
Nom
Classe
Formule
semi-
développée
Formule
2,4-
DNPH
Liqueur de
Fehling
Famille organique ; formule
semi-développée ; nom
(I)
MnO4-(aq)
(II)
MnO4-(aq)
d) Dans deux tubes à essai, introduis 1 mL de butanal et 1 mL de butanone. Ajoute la solution oxydante en milieu
acide. Qu’observes-tu et que peux-tu en déduire si on place l’oxydant en excès avec un alcool (I) ou (II) ?
…………………………………………………………………………………………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………………………………………………………………………………………
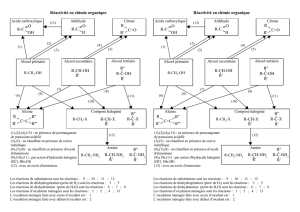
3- Conclusion sur l’oxydation ménagée des alcools (I), (II) et (III) avec l’oxydant en défaut ou en excès :
a) Sachant que l’oxydation totale des alcools correspond à la combustion des alcools, pourquoi parle-t-on
d’oxydation ménagée pendant ce TP ? ……………………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………………………………………………………………………………………
b)
c) Complète les demi-équations électroniques des couples oxydant / réducteur rencontrées pendant le TP :
ion permanganate / ion manganèse : …… MnO4- (aq) + …… H+ (aq) + …… e- = …… Mn2+ (aq) + …… H2O (l)
butanal / butan-1-ol : …… CH3-CH2-CH2-CHO (aq) + …… H+ (aq) + …… e- = …… CH3-CH2-CH2-CH2-OH (aq)
butanone / butan-2-ol : …… CH3-CH2-CO-CH3 (aq) + …… H+ (aq) + …… e- = …… CH3-CH2-CHOH-CH3 (aq)
acide butanoïque / butanal : …… CH3-CH2-CH2-COOH (aq) + …… H+ (aq) + …… e- = …… CH3-CH2-CH2-CHO (aq) + …… H2O (l)
d) Ecris les équations de réaction de l’oxydation ménagée des alcools de classe (I), (II) et (III).
Alcool (I)
Alcool (II)
Alcool (III)
Oxydant en défaut
ou en excès
Oxydant en excès
1
/
2
100%