Lire l`article complet

Figure 1. Examen tomodensitométrique, coupes axiales (A et B) et coronales (C et D),
sans injection de produit de contraste, d’un patient présentant une anosmie liée à une
polypose naso-sinusienne. On note des opacités diffuses de l’ethmoïde et des grands
sinus. L’index de Lund-McKay est de 20.
A
C
B
D
La Lettre d’ORL et de chirurgie cervico-faciale • n° 321 - avril-mai-juin 2010 | 5
DOSSIER THÉMATIQUE
Spécial “Odorat”
Imagerie des troubles
de l’odorat
Imaging and olfaction
P. Bonfils*, M. Devars du Maine*, D. Malinvaud*, O. Laccourreye*
* Département d’ORL et de chirurgie
cervico-faciale, hôpital européen
Georges-Pompidou, faculté de
médecine Paris-Descartes, univer-
sité Paris-V, unité de recherche CNRS
CeSeM (Centre d’études de la sensori-
motricité), UMR 8194, Paris.
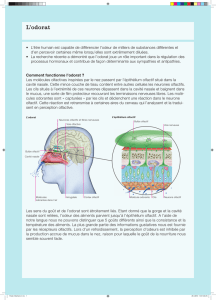
L’odorat est un sens chimique qui résulte d’une
série d’événements faisant suite au contact
de certaines molécules dites “odorantes” avec
des récepteurs spécifiques localisés dans le neuro-
épithélium olfactif. Cette succession d’événements
comporte quatre étapes. La première d’entre elles est
l’aéroportage. Dans cette étape aérodynamique, les
molécules odorantes entraînées dans le courant d’air
nasal atteignent la partie haute de la fente olfactive où
se situe le neuro-épithélium olfactif. Dans la deuxième
étape, dénommée “événements péri-récepteurs”, les
molécules odorantes, souvent hydrophobes, traversent
la fine couche de mucus recouvrant le neuro-épithélium
olfactif afin d’atteindre les cils des neurones olfactifs
primaires. La troisième étape est la transduction ; c’est
la traduction du message chimique en un message
électrique. Cette étape s’effectue dans les neurones
olfactifs primaires. Enfin, la dernière étape est l’in-
tégration centrale, réalisée dès le bulbe olfactif et se
poursuivant dans les aires corticales olfactives. Chacune
de ces quatre étapes physiologiques a ses spécificités
fonctionnelles, mais également sa propre sémiologie
et ses propres pathologies.
La démarche diagnostique devant une dysosmie quan-
titative (hyposmie ou anosmie) doit comprendre deux
stades : un diagnostic topographique puis un diagnostic
étiologique. L’imagerie médicale est souvent nécessaire,
voire indispensable à certains diagnostics.
La démarche diagnostique à suivre devant une
dysosmie qualitative (cacosmie, parosmie, phantosmie)
est fondée sur une analyse sémiologique exacte de la
dysosmie.
Les dysosmies liées
à un trouble de l’aéroportage
Deux grands types d’étiologies sont théoriquement
susceptibles d’affecter l’aéroportage : les anomalies
anatomiques nasales et sinusiennes, et la pathologie
inflammatoire chronique des cavités naso-sinusiennes.
Néanmoins, les travaux étudiant les relations entre
les anomalies anatomiques des cavités nasales et les
troubles de l’odorat semblent conclure qu’une dimi-
nution du calibre des fosses nasales par un obstacle
purement anatomique (une déviation septale, une
concha bullosa, un éperon septal volumineux) n’af-
fecte pas les qualités de l’odorat (1, 2). À l’opposé, l’aé-
roportage peut être altéré par la présence de lésions

6 | La Lettre d’ORL et de chirurgie cervico-faciale • n° 321 - avril-mai-juin 2010
Points forts
»
La physiologie de l’odorat comporte quatre étapes : l’aéroportage, les événements péri-récepteurs,
la transduction et l’intégration centrale. À chaque étape correspondent des diagnostics différents pour
lesquels l’imagerie médicale a une place précise.
»
L’imagerie de l’aéroportage repose sur l’examen tomodensitométrique des cavités naso-sinusiennes. Les
contraintes techniques doivent impérativement être respectées afin d’obtenir une analyse précise des lésions.
»Aucune imagerie n’est utile dans la pathologie des événements péri-récepteurs.
»
L’imagerie de la transduction est limitée aux diagnostics différentiels avec les pathologies de l’aéroportage.
»
L’imagerie de la pathologie centrale est dominée par l’IRM cérébrale qui permet de visualiser les tumeurs
(méningiome olfactif) ou l’agénésie bulbaire (anosmie congénitale).
Mots-clés
Dysosmie
Examen
tomodensitométrique
IRM cérébrale
Cacosmie
Méningiome olfactif
Highlights
Olfactory physiology includes
four parts: nasal airflow physio-
logy, olfactory mucus secretion,
transduction and central olfac-
tory physiology. Diagnosis and
medical imaging vary as a func-
tion of the aetiology.
CT scan is the main medical
imaging method to explore
smell and taste disorders due
to nasosinusal pathologies.
A strict methodology is needed.
Medical imaging is not neces-
sary to explore olfactory mucus
pathology.
Medical imaging is not neces-
sary to explore the transduc-
tion.
RMI is the main medical
imaging method to explore
central olfactory pathology,
either tumors (olfactory groove
meningiomas), or congenital
anosmia.
Keywords
Dysosmia
CT scan
RMI
Cacosmia
Olfactory groove
meningiomas
obstructives, polypoïdes ou tumorales, présentes dans
la fente olfactive. L’exemple le plus typique est celui
de la polypose naso-sinusienne.
La polypose naso-sinusienne est la cause la plus
fréquente de dysosmie par altération de l’aéropor-
tage. La dysosmie est le signe majeur de la polypose
naso-sinusienne (3). Le diagnostic est clinique ; il est
porté devant la présence, bilatérale et le plus souvent
symétrique, de polypes dans les 2 cavités nasales. Les
polypes sont situés en dehors du cornet nasal moyen
dans la moitié antérieure des cavités nasales (prove-
nant des cellules ethmoïdales antérieures situées en
avant de la lame basale du cornet moyen), et ils sont
situés en dedans de ce même cornet dans la moitié
postérieure de la cavité nasale (provenant des cellules
ethmoïdales postérieures situées en arrière de la lame
basale du cornet moyen). L’examen tomodensitomé-
trique de la face est réalisé en coupes axiales et coro-
nales, sans injection de produit de contraste (figure 1).
Il doit être réalisé en dehors d’une poussée inflamma-
toire récente (qui majorerait les opacités) et à distance
d’un traitement corticoïde per os récent (qui minorerait
les opacités). Un délai de 4 à 6 semaines est nécessaire
après de tels événements. Cet examen permet de :
– confirmer l’atteinte panethmoïdale bilatérale et à
peu près symétrique ;
– quantifier l’importance des opacités sinusiennes
par l’index de Lund-McKay (tableau) [4] ;
– rechercher des lésions associées pouvant majorer
la réaction inflammatoire (comme une aspergillose
maxillaire) ;
– étudier les variations anatomiques en cas d’indi-
cation opératoire.
Les dysosmies liées à une
altération des événements
péri-récepteurs
Avant de se fixer sur le récepteur du neurone olfactif
primaire, les molécules odorantes doivent traverser
la couche de mucus nasal. Or, de nombreuses molé-
cules odorantes sont hydrophobes. Des protéines
spécifiques transportant les molécules odorantes à
travers la couche de mucus ont été isolées : ce sont
les odorant binding proteins (OBP).
La principale pathologie des événements péri-
récepteurs est la rhinite chronique. Environ 35 %
des patients ayant une rhinite chronique se plaignent
de dysosmie, généralement d’hyposmie modérée.
Aucun examen radiographique n’est indispensable
au diagnostic ; un doute diagnostique avec une autre
pathologie rhino-sinusienne chronique doit conduire
à réaliser un examen tomodensitométrique de la face
sans injection, qui se révélera normal (5).
Les dysosmies liées à
une altération
de la transduction
Le neurone olfactif primaire effectue la transduction :
c’est la traduction du message chimique en message
électrique : une variation de potentiel intracellulaire.
Les neurones olfactifs primaires ont une durée de
vie courte, limitée à quelques mois, ce qui impose
un renouvellement permanent. Ce renouvellement
est effectué à partir des cellules basales.
Tableau. Calcul de l’index de Lund-Mac-Kay. Pour chaque côté (droit et gauche), la somme des nombres correspondant à
chaque sinus doit être calculée. L’addition des deux sommes (côtés droit et gauche) donne l’index total. En cas d’opacité
totale de toutes les cavités naso-sinusiennes, l’index est de 24 sur 24.
Normal Opacité partielle Opacité totale
Sinus maxillaire 0 1 2
Ethmoïde antérieur 0 1 2
Ethmoïde postérieur 0 1 2
Sinus sphénoïdal 0 1 2
Sinus frontal 0 1 2
Méat moyen 0 1 2
Total 0 6 12

Figure 2. Examen tomodensitométrique, en coupe
axiale, sans injection de produit de contraste, d’un
patient présentant une dysosmie semblant consécu-
tive à une rhinite aiguë. Néanmoins, il présente depuis
des années des symptômes rhinologiques modérés
dominés par une obstruction nasale et une rhinorrhée
postérieure. Ces symptômes mineurs doivent conduire
à réaliser un examen tomodensitométrique, qui révèle
des opacités panethmoïdales modérées, antérieures
(EA) et postérieures (EP) en avant et en arrière de la
lame basale du cornet moyen (pointillés), permettant
de porter le diagnostic de rhino-sinusite diffuse.
La Lettre d’ORL et de chirurgie cervico-faciale • n° 321 - avril-mai-juin 2010 | 7
DOSSIER THÉMATIQUE
Spécial “Odorat”
La pathologie de la transduction olfactive est riche.
Elle est largement dominée par les dysosmies post-
rhinitiques (postviral olfactory loss, influenza-like
infection, post upper respiratory infection [URI])
qui représentent la première cause de dysosmie
dans le monde, et dont la prévalence est estimée
entre 15 et 35 % des dysosmies. Aux États-Unis,
R.I. Henkin et al. ont estimé cette prévalence à
1 patient pour 400 habitants, ce qui représente-
rait 150 000 sujets en France (6-8). Ce type de
dysosmie affecte particulièrement les femmes
(65 à 70 %) d’un âge moyen compris entre 50 et
60 ans. La dysosmie serait essentiellement liée à
une destruction des neurones olfactifs primaires.
Le principal problème diagnostique est d’établir
avec certitude la relation exacte entre la rhinite
aiguë et la dysosmie. Durant toute rhinite aiguë,
une hyposmie transitoire – souvent une anosmie
– s’installe ; elle est liée à l’obstruction nasale
secondaire à l’œdème muqueux et à la présence
d’abondantes sécrétions. Lorsque l’obstruction et la
rhinorrhée s’estompent après une dizaine de jours,
l’odorat se normalise. Si la perte olfactive persiste
après la guérison de la rhinite, on parle de dysosmie
post-rhinitique. Dans la plupart des cas, la prise de
conscience de cette évolution inhabituelle de la
dysosmie n’est pas immédiate. Le patient attend
le plus souvent plusieurs mois avant de prendre
effectivement conscience de la persistance du
trouble olfactif. Le point capital du diagnostic est
d’établir la relation étroite entre la dysosmie et la
rhinite aiguë : la dysosmie doit être immédiatement
consécutive à la rhinite aiguë. La dysosmie est le
plus souvent à la fois une dysosmie quantitative
(l’hyposmie semble plus fréquente que l’anosmie
[60 versus 40 %]) et une dysosmie qualitative,
dominée par les parosmies, qui sont fréquentes
(30 à 50 % des cas). Ainsi, le diagnostic de dysosmie
post-rhinitique est clinique et repose sur l’interro-
gatoire : la chronologie de l’atteinte, l’absence de
symptômes rhino-sinusiens et neurologiques. Un
doute peut subsister lorsqu’il existe des symptômes
rhino-sinusiens (du fait de la fréquence des rhinosi-
nusites chroniques dans la population générale). Il
convient alors de différencier une dysosmie post-
rhinitique d’une dysosmie liée à une poussée de
rhinosinusite diffuse. La présence de polypes dans
les cavités nasales orientera le diagnostic. En leur
absence, il est préférable de réaliser un examen
tomodensitométrique des cavités naso-sinusiennes,
en coupes axiales et coronales, sans injection de
produit de contraste. La présence d’opacités diffuses
ethmoïdales antérieures et postérieures, en avant
et en arrière de la lame basale du cornet moyen,
permettra de rectifier le diagnostic (figure 2).
Les autres étiologies des dysosmies sont beau-
coup plus rares. L’altération des neurones olfac-
tifs primaires peut être d’origine toxique (chimie
lourde), médicamenteuse (exceptionnel), médicale
(pathologie rénale, hépatique) ou liée au vieillisse-
ment. Aucun examen radiographique n’est utile. Le
diagnostic est essentiellement fondé sur l’interro-
gatoire (9-12).
Les dysosmies centrales
La première étape centrale dans le système olfactif
est l’étape bulbaire. Le bulbe olfactif a une chimio-
topie : chaque glomérule est une unité fonction-
nelle. Ainsi, il semble exister un codage spatial des
odeurs dans le bulbe olfactif. Les axones des cellules
mitrales bulbaires empruntent le tractus olfactif
latéral et se projettent dans diverses structures,
dont le cortex olfactif. Le cortex piriforme est la
principale structure corticale olfactive. Les 2 prin-
cipales étiologies des dysosmies d’origine centrale
sont les traumatismes crâniens (13) et la maladie
d’Alzheimer (14).

Figure 4. Examen par résonance nucléaire magnétique
cérébrale chez une patiente présentant une anosmie,
probablement congénitale. L’IRM cérébrale centrée
sur les bulbes et tractus olfactifs permet de confirmer
le diagnostic en montrant l’absence de bulbe olfactif.
Figure 3. Examen par résonance nucléaire magnétique cérébrale chez un patient présentant
une hyposmie progressive menant en 5 ans à une anosmie, sans étiologie évidente. Le
scanner (A) et l’IRM cérébrale (B) révèlent un volumineux méningiome olfactif.
A B
8 | La Lettre d’ORL et de chirurgie cervico-faciale • n° 321 - avril-mai-juin 2010
Imagerie des troubles de l’odorat
DOSSIER THÉMATIQUE
Spécial “Odorat”
La fréquence des dysosmies post-traumatiques
est importante (de 11 à 19 % des dysosmies). Elle
représente la seconde cause de dysosmie selon la
littérature. La prévalence des dysosmies dans les
traumatismes crâniens est estimée à 5,3 % (13). Le
lien entre le traumatisme crânien et l’apparition de
la dysosmie est parfois difficile quand le trauma a
été compliqué d’une longue période de coma. La
dysosmie est le plus souvent une anosmie (60 %
des cas), plus rarement une hyposmie (40 %). Une
parosmie est souvent associée au trouble quanti-
tatif (40 % des cas). La dysosmie est liée à 3 méca-
nismes plus ou moins associés : un cisaillement
des axones des neurones olfactifs primaires dans
la lame criblée ; des lésions du neuro-épithélium
olfactif, notamment lors de brèches de l’étage
antérieur de la base du crâne ; des lésions des
centres olfactifs. L’étude par résonance magné-
tique nucléaire cérébrale des patients dysosmiques
après un traumatisme crânien permet de visualiser
des lésions intra crâniennes fréquentes : 83 % des
patients avaient des lésions bilatérales des bulbes
olfactifs (15). Néanmoins, le diagnostic de dysos-
mies post-traumatiques est clinique et repose sur
l’interrogatoire. L’examen tomodensitométrique
de la base du crâne a essentiellement pour but de
visualiser une éventuelle brèche osseuse.
La seconde étiologie des dysosmies centrales est le
vieillissement du système olfactif, que celui-ci soit
normal ou pathologique. La maladie d’Alzheimer,
par exemple, atteint de manière précoce le système
olfactif (14). L’un des problèmes majeurs actuels est
de savoir si l’apparition d’une anosmie progressive
chez un sujet de moins de 65 ans ne serait pas le
premier marqueur d’une maladie d’Alzheimer à
venir. L’importance de la dysosmie semble directe-
ment liée à la gravité de la démence. Aucun examen
radiographique n’est utile.
Il existe des atteintes tumorales du système olfactif
central dominées par le classique méningiome
olfactif, qui ne représente que 0,5 % des étiolo-
gies des dysosmies. Sa recherche ne doit pas être
systématique mais résulte de l’élimination systé-
matique des autres étiologies de dysosmie. Après
avoir éliminé les étiologies les plus fréquentes
(dysosmies post-rhinitique, post-traumatique,
par dysfonctionnement rhinosinusien ou liée à
l’âge), l’absence d’étiologie évidente devant une
hyposmie progressive menant à l’anosmie doit faire
rechercher un méningiome. L’imagerie est alors
indispensable (16) ; l’IRM est l’examen de choix
(figure 3).
Parmi les causes rares de dysosmie centrale,
l’anosmie congénitale représente entre 1 et 2 %
des consultations pour dysosmie. Dans ce type
d’anosmie, le sujet n’a jamais senti. Il faut éliminer
– ce qui est souvent difficile –, par un interrogatoire
strict, les autres causes de dysosmie de la petite
enfance (traumatisme crânien, malformation céré-
brale, etc.). L’imagerie médicale est essentielle :
l’IRM cérébrale (figure 4) permet de visualiser l’ab-
sence de bulbe et de tractus olfactifs (17). Seul ce
cadre diagnostique permet de constater une telle
anomalie.

Figure 5. Examen tomodensitométrique, en coupe
coronale, sans injection de produit de contraste, d’un
patient présentant une cacosmie. L’examen tomoden-
sitométrique permet d’affirmer le diagnostic topogra-
phique de sinusite antérieure de la face bilatérale avec,
du côté gauche, des lésions dentaires responsables de
la sinusite, et du côté droit, une greffe aspergillaire.
La Lettre d’ORL et de chirurgie cervico-faciale • n° 321 - avril-mai-juin 2010 | 9
DOSSIER THÉMATIQUE
Spécial “Odorat”
Les cacosmies
La cacosmie est définie par l’existence d’une
mauvaise odeur dans les cavités naso-sinu-
siennes (18). Plusieurs étiologies peuvent être
évoquées : les sinusites d’origine dentaire, les
mycoses sinusiennes, le reflux gastro-œsophagien
et les infections chroniques dentaires et amyg-
daliennes. La recherche d’une sinusite antérieure
de la face d’origine dentaire repose sur l’examen
tomodensitométrique des cavités naso-sinusiennes,
en coupes axiales et coronales, sans injection de
produit de contraste, associé à un dentascanner
(figure 5). Le dentascanner a une forte valeur
diagnostique par rapport aux clichés rétroal-
véolaires et au panoramique dentaire. En effet,
ces 2 derniers types de clichés étant des clichés
plans, ils entraînent des superpositions des diffé-
rentes structures dentaires ne permettant pas une
analyse fine des apex dentaires. Il ne faut donc
pas se contenter de tels clichés lorsqu’une origine
dentaire est suspectée devant une cacosmie. Paral-
lèlement, l’origine mycotique de la cacosmie repose
sur l’examen tomodensitométrique : la présence de
microcalcifications au sein de l’opacité signe l’as-
pergillose (figure 5). Chez un patient immunodé-
primé ou diabétique, une sinusite fongique invasive
doit être suspectée : l’examen tomodensitomé-
trique et l’IRM sont 2 examens complémentaires.
Les parosmies
La parosmie (19) est définie par la présence d’une
odeur, souvent qualifiée de désagréable, en réponse
à une stimulation olfactive. Ainsi, l’odeur du café
peut être perçue sous forme d’une odeur de plas-
tique brûlé ou d’excréments. La présence d’une
parosmie signe une atteinte neurosensorielle
olfactive, le plus souvent liée à une atteinte du
neuro-épithélium olfactif : dysosmie post-rhini-
tique et dysosmie post-traumatique dominent les
étiologies. L’imagerie médicale n’est pas utile au
diagnostic.
Les hallucinations olfactives
ou phantosmies
Les hallucinations olfactives ou phantosmies sont
des perceptions d’odeurs qui n’ont pas de réalité
physique. Elles sont toujours graves. Les étiolo-
gies sont dominées par les causes psychiatriques
(schizophrénie) et par les tumeurs cérébrales (20).
Conclusion
La diversité des étiologies des dysosmies impose
une enquête fondée sur un interrogatoire et un
examen clinique rigoureux. L’imagerie médicale ne
doit pas être conçue comme un outil systématique.
Les demandes doivent être raisonnées, fondées
sur des hypothèses diagnostiques et étiologiques.
Ainsi, la demande d’IRM cérébrale systématique
afin d’éliminer l’hypothèse de méningiome olfactif
n’a pas lieu d’être. Les examens tomodensito-
métriques des cavités naso-sinusiennes seront
demandés devant des pathologies de l’aéropor-
tage et des cacosmies (le dentascanner est parfois
l’élément clé du diagnostic). L’examen IRM sera
demandé devant une crainte de pathologie endo-
crânienne dominée par les tumeurs méningées et
cérébrales. ■
 6
6
1
/
6
100%