Troubles mictionnels de l`enfant - chu

Journal
de
pédiatrie
et
de
puériculture
(2013)
26,
210—221
Disponible
en
ligne
sur
www.sciencedirect.com
ARTICLE
EMC
Troubles
mictionnels
de
l’enfant
Urination
problems
in
the
child
E.
Bérard∗,
J.
Bréaud,
I.
Oborocianu,
F.
Bastiani
France
Introduction
Les
fuites
urinaires
sont
fréquentes
et
invalidantes
chez
l’enfant.
Non
prises
en
charge,
elles
peuvent
persister
à
l’âge
adulte.
Outre
les
troubles
mictionnels,
qui
regroupent
les
dysfonctions
de
l’élimination
urinaire
(primitives
et/ou
secondaires)
et
l’énurésie,
d’autres
fuites
urinaires
non
mictionnelles
doivent
être
recherchées.
Une
approche
clinique
simple
permet
souvent
une
prise
en
charge
adaptée
permettant
une
guérison
ou
une
amélioration
franche.
Ne
pouvant
faire
une
revue
exhaustive
de
la
littérature,
nous
renvoyons,
sauf
point
par-
ticulier,
aux
mises
au
point
récentes
[1—3].
Ce
texte
s’appuie
sur
les
nouvelles
définitions
de
l’International
Children
Continence
Society
(ICCS)
[2].
Pour
l’énurésie,
nous
utilisons
un
consensus
d’experts
[3].
Les
vessies
neurologiques,
qui
peuvent
occasionner
des
fuites
urinaires,
ne
sont
pas
traitées
dans
cet
article.
Physiologie
de
la
miction
Maturation
physiologique
et
régulation
de
la
miction
La
vessie
se
vide
dès
avant
la
naissance
par
un
réflexe
mictionnel
médullaire
sacré
qui
coordonne
les
dix
à
14
muscles
(striés
et
lisses)
impliqués
dans
la
miction,
enchaînant
la
décontraction
du
périnée,
l’ouverture
des
sphincters
vésicaux,
la
contraction
du
détrusor
et
l’abaissement
des
pressions
urétrales
[4].
À
quelques
jours
de
vie,
la
miction
survient
∗Auteur
correspondant.
Adresse
e-mail
:
(E.
Bérard).
0987-7983/$
—
see
front
matter
©
2013
Publié
par
Elsevier
Masson
SAS.
http://dx.doi.org/10.1016/j.jpp.2013.04.007

Troubles
mictionnels
de
l’enfant
211
20
fois
par
jour,
déclenchée
par
le
stimulus
proprioceptif
de
la
distension
vésicale,
mais
aussi
par
la
stimulation
cutanée
périnéale
[4,5].
Entre
la
naissance
et
l’âge
de
deux
ans,
ce
réflexe
est
progressivement
inhibé
par
des
influx
provenant
d’abord
de
centres
médullosacrés,
puis
lombaires,
dorsaux,
bulbaires,
tronculaires
et
enfin
cérébraux,
aboutissant
à
six
à
huit
mictions
par
jour
à
deux
ans
[4,6].
Vers
18
mois,
l’enfant,
contrôlant
volontairement
le
sphincter
strié,
peut
retenir
une
miction
réflexe,
induisant
l’augmentation
de
sa
capacité
vésicale
et
l’inhibition
de
la
contraction
réflexe
du
détrusor
[4,6,7].
La
continence
diurne
puis
nocturne
résulte
d’une
matura-
tion
physiologique
progressive
entre
1,5
ans
et
cinq
ans,
qui
synchronise
le
cycle
nycthéméral
de
la
diurèse
(et
son
osmo-
larité),
la
capacité
vésicale
et
l’activité
du
détrusor
[8].
Les
âges
moyens
des
étapes
d’acquisition
de
la
continence
[9]
sont
que
l’enfant
à
18
mois
indique
qu’il
est
mouillé,
à
24
mois
acquiert
le
contrôle
diurne,
à
36
mois
contrôle
par-
tiellement
les
mictions
nocturnes,
à
42
mois
est
propre
jour
et
nuit
avec
des
incidents
nocturnes
occasionnels
jusqu’à
cinq
ou
six
ans.
Ainsi,
80
%
des
enfants
sont
continents
la
nuit
à
cinq
ans.
Parmi
les
20
%
restants,
15
%
par
an
guérissent
spontanément
[9,10].
Facteurs
de
la
continence
Une
fuite
urinaire
survient
lorsqu’il
y
a
inadéquation
entre
trois
paramètres
:
le
volume
d’urine,
la
capacité
vésicale
et
les
moyens
(musculaires
et
nerveux)
de
la
continence.
Du
fait
du
cycle
nycthéméral
de
l’hormone
antidiuré-
tique
(ADH),
le
volume
d’urines
diurne
est
le
double
du
volume
nocturne,
et
l’osmolarité
urinaire
nocturne
supé-
rieure
à
celle
de
la
journée
[11].
On
peut
le
mesurer
par
la
comparaison
des
volumes
urinaires
nocturnes
(pesée
des
couches)
et
diurnes,
et
la
mesure
de
l’osmolarité
urinaire
(ou
l’évaluer
par
la
densité
urinaire
à
la
bandelette).
La
capacité
vésicale
(CV)
théorique
peut
être
calcu-
lée
selon
la
formule
de
Koff
[12]
:
CV
ml
=
(30
×
âge
en
années)
+
30
avant
l’âge
de
12
ans.
La
CV
fonctionnelle
est
mesurée
par
la
cystomanométrie
ou
plus
récemment
éva-
luée
en
échographie
[13].
La
CV
fonctionnelle
estimée
[14]
est
le
plus
gros
volume
que
le
patient
est
capable
de
retenir
(test
sur
quatre
jours
avec
des
apports
liquidiens
contrôlés),
mais
cette
évaluation
est
imparfaite
car
variable
d’un
jour
à
l’autre.
Si
la
polyurie
ou
une
«
petite
vessie
»
expliquent
la
réplé-
tion
vésicale
plus
rapide,
celle-ci
devrait
déclencher
le
besoin
avec
le
contrôle
de
la
miction.
Donc,
l’origine
de
la
fuite
est
aussi
à
rechercher
dans
le
contrôle
musculonerveux
de
la
miction.
Le
contrôle
musculonerveux
de
l’élimination
urinaire
repose
sur
l’alternance
de
phases
de
remplissage
et
de
mic-
tions
(Fig.
3).
Lors
du
remplissage,
le
détrusor
se
laisse
distendre
en
maintenant,
malgré
l’augmentation
de
volume
d’urine,
une
pression
inférieure
au
tonus
sphinctérien.
Lors
de
la
miction,
la
pression
vésicale
augmente
par
la
contrac-
tion
du
détrusor
et
devient
supérieure
à
la
pression
urétrale,
qui
elle-même
chute
brutalement
après
relâchement
du
sphincter.
La
coordination
musculaire
nécessaire
vient
de
centres
nerveux
de
commande
(notamment
noyaux
gris
centraux),
mais
aussi
du
système
nerveux
végétatif
et
des
centres
d’intégration
de
ces
influx
volontaires
et
automatiques.
Les
informations
passent
par
des
voies
neurologiques
afférentes
et
efférentes
aux
effecteurs
musculaires
(détrusor,
appareil
sphinctérien
et
urètre).
On
peut
mettre
en
cause
chacun
de
ces
mécanismes
dans
les
troubles
de
contrôle
de
la
miction
et
cette
classification
oriente
la
recherche
vers
de
nouvelles
voies
thérapeutiques.
POINT
FORT
Physiologie
•La
miction
est
un
automatisme
anténatal
à
commande
initialement
médullaire
puis
contrôlée
par
des
centres
supérieurs.
Le
contrôle
volontaire
autorise
ou
interdit
la
miction
dont
le
déroulement
est
inscrit
dans
les
automatismes.
•Le
contrôle
volontaire
diurne
apparaît
vers
deux
ans,
et
le
contrôle
nocturne
entre
deux
et
cinq
ans
chez
80
%
des
enfants.
•Une
fuite
urinaire
résulte
de
l’inadéquation
du
volume
urinaire,
de
la
capacité
vésicale
et
des
moyens
de
contrôle
(musculaires
et
nerveux)
de
la
continence.
Définitions
La
littérature
sur
les
troubles
mictionnels
manquait
de
définitions
consensuelles.
Les
définitions
de
l’ICCS
doivent
maintenant
être
exclusivement
utilisées
[2],
ainsi
que
leurs
traductions
franc¸aises
proposées
par
l’Association
franc¸aise
d’urologie
(AFU)
[15].
Cette
terminologie
récente
rend
dif-
ficile
l’interprétation
des
résultats
des
études
antérieures.
L’incontinence
urinaire
est
une
perte
d’urine
incontrô-
lable
qui
peut
être
permanente
ou
intermittente.
L’incontinence
permanente
est
une
fuite
permanente
sans
véritable
miction.
Elle
fait
donc
partie
du
diagnostic
différentiel
des
troubles
mictionnels
et
se
rencontre
dans
les
malformations
des
voies
urinaires
(abouchements
ecto-
piques
de
l’uretère,
fistule
vésicovaginale,
etc.).
L’incontinence
intermittente
est
un
défaut
occasionnel
de
la
continence
urinaire
diurne
et/ou
nocturne.
L’énurésie
nocturne
(En)
est
une
incontinence
intermit-
tente
exclusivement
pendant
le
sommeil
(nuit
ou
sieste)
chez
des
enfants
d’au
moins
cinq
ans.
L’En
est
primaire
(EnP)
si
l’enfant
n’a
jamais
eu
de
continence
durant
le
sommeil
pendant
plus
de
six
mois.
Elle
s’oppose
à
l’énurésie
secon-
daire
où,
après
une
période
de
contrôle
de
plus
de
six
mois,
les
incontinences
réapparaissent
pendant
le
sommeil.
L’énurésie
primaire
est
dite
isolée
(EnPI)
ou
monosympto-
matique
s’il
n’existe
aucun
autre
symptôme,
en
particulier
diurne,
relevant
du
bas
appareil
urinaire.
Seule
la
nycturie
(réveil
nocturne
par
un
besoin
mictionnel)
peut
être
asso-
ciée
à
l’EnPI.
La
définition
de
l’EnPI
exclut
donc
tous
les
symptômes
rapportés
en
encadré,
qui
sont
des
signes
d’incontinence
intermittente
diurne/nocturne
par
dysfonction
de
l’élimination
d’urine,
primitive
ou
secondaire
[2,15].
Le
terme
d’énurésie
diurne
doit
être
évité.

212
E.
Bérard
et
al.
POINT
FORT
Symptômes
diurnes
de
dysfonction
de
l’élimination
d’urine
primitive
ou
secondaire
•Fréquence
anormale
des
mictions
(trop
fréquentes,
plus
de
sept
par
jour,
ou
trop
rares,
moins
de
quatre
par
jour),
chez
un
enfant
de
plus
de
cinq
ans.
•Incontinence
diurne
même
minime.
•Impériosité
mictionnelle
non
contenue
(à
plus
de
cinq
ans).
C’est
un
besoin
subit,
inattendu
et
immédiat
d’uriner.
•Faux
besoins
(non
suivis
de
miction),
hésitation,
retard
à
la
miction
(enfant
de
plus
de
cinq
ans
ou
ayant
un
contrôle
vésical
diurne).
•Efforts
de
poussée
abdominale
à
la
miction,
pour
initier
et
maintenir
la
vidange
vésicale
(quel
que
soit
l’âge
de
l’enfant).
•Faiblesse
du
jet,
jet
irrégulier.
•Miction
fractionnée
(considérée
comme
physiologique
jusqu’à
trois
ans,
si
elle
n’est
pas
accompagnée
de
poussée
abdominale).
•Manœuvres
de
retenue
(accroupissement,
pincement
de
la
verge,
croisement
des
jambes,
agitation,
debout
sur
la
pointe
des
pieds,
etc.).
•Sensations
de
vidange
vésicale
incomplète,
gouttes
résiduelles,
cystalgies
ou
douleurs
génitales
(décrites
par
les
plus
âgés
vers
l’adolescence).
Ces
symptômes,
souvent
difficiles
à
mettre
en
évidence
chez
l’enfant
de
moins
de
huit
ans,
peuvent
être
révé-
lés
par
un
calendrier
mictionnel
précis
après
normalisation
des
apports
hydriques.
Ils
doivent
être
recherchés
par
un
interrogatoire
rigoureux,
illustré
et
soigneux,
car
souvent
négligés
par
les
parents,
et
sont
alors
retrouvés
chez
20
%
à
45
%
des
enfants
consultant
pour
«
énurésie
nocturne
»
[16,17].
Il
faut
noter
que
la
fréquence
des
symptômes
n’entre
pas
dans
les
définitions.
Un
épisode
unique
suffit.
Classification
physiopathologique
des
troubles
de
l’élimination
urinaire
En
dehors
de
l’EnPI
qui
est
une
entité
physiopathologique
particulière,
les
autres
dysfonctionnements
vésicaux
sont
(dans
un
souci
de
clarté)
classés
selon
la
phase
de
surve-
nue
(remplissage
ou
vidange)
et
non
l’étiologie
(primitive
ou
secondaire)
[18].
Les
troubles
pendant
le
remplissage
ont
des
symptômes
à
type
de
fuites
et/ou
urgenturie,
et
ceux
de
la
miction
des
dysuries.
En
clinique,
il
est
difficile
de
séparer
ces
deux
types
de
troubles
qui
sont
souvent
intriqués
et
les
modes
de
prise
en
charge
des
formes
primitives
ne
sont
pas
encore
clairement
séparés.
Dysfonctionnement
de
la
phase
de
remplissage
À
la
phase
de
remplissage,
la
désinhibition
détrusorienne
est
la
principale
cause
mais
l’instabilité
urétrale
peut
être
aussi
en
cause.
Causes
détrusoriennes
Une
contraction
désinhibée
du
détrusor
(CDD)
pendant
le
remplissage
peut
augmenter
la
pression
vésicale
au-delà
de
la
pression
de
clôture
sphinctérienne
et
provoquer
la
fuite
urinaire
(anciennement
dénommé
vessie
hyperactive
ou
instabilité
vésicale).
La
CDD
primitive
est
une
cause
fréquente
de
fuites
urinaires
diurnes
et/ou
nocturnes.
Elle
est
due
à
une
immaturité
vésicale
[19],
et
résulte
du
conflit
entre
une
contraction
sphinctérienne
maîtrisée
par
l’enfant
et
la
persistance
de
l’hyperactivité
du
détrusor.
Cette
instabi-
lité
peut
être
transitoire
pendant
quelques
mois
lors
de
l’apprentissage
de
la
propreté
diurne
vers
deux
ans
et
doit
disparaître
ensuite.
La
CDD
peut
favoriser
la
survenue
d’infections
urinaires
et/ou
de
reflux
vésico-urétéral,
ces
complications
régressant
après
traitement
[19—21].
Sa
per-
sistance
à
long
terme
peut
aboutir
à
une
grande
vessie
rétentionniste
à
mictions
rares
par
hypocontractilité
détru-
sorienne.
La
CDD
peut
aussi
être
secondaire
à
une
inflammation
de
l’urothélium
vésical
par
une
infection,
des
cristalluries
ou
lithiases,
ou
la
présence
d’un
résidu
post-mictionnel.
Chacun
de
ces
facteurs
favorise
les
deux
autres
[19].
La
dys-
urie
fait
partie
des
signes
cardinaux
de
l’infection
urinaire.
De
même,
l’émission
de
sables
urinaires,
le
plus
souvent
par
hypercalciurie,
provoque
une
dysfonction
vésicale
avec
parfois
dysurie,
pollakiurie,
incontinence
diurne,
urgence
mictionnelle
et
infections
urinaires
récurrentes
[22].
Une
hypercalciurie
est
retrouvée
chez
28
%
des
patients
consul-
tant
pour
un
trouble
mictionnel
[23].
Chez
un
enfant
de
plus
de
cinq
ans,
elle
est
mise
en
évidence
sur
un
échan-
tillon
d’urines
par
un
rapport
calcium/créatinine
supérieur
à
0,5
mmol/mmol.
Le
récent
enrichissement
en
vitamine
D
de
produits
laitiers
vendus
en
France
a
sans
doute
augmenté
la
fréquence
de
ce
trouble,
surtout
s’il
est
associé
à
une
insuffisance
des
boissons
(hyperconcentration
des
urines).
L’augmentation
des
boissons
et
la
suppression
de
toute
vita-
mine
D
médicamenteuse,
mais
aussi
alimentaire,
corrige
souvent
ce
trouble.
La
CDD
peut
aussi
résulter
d’une
mauvaise
com-
mande
nerveuse
du
système
nerveux
central
comme
dans
l’incontinence
au
fou
rire,
fréquente
chez
les
préadoles-
centes
(familiale
dans
13
%
à
28
%
des
cas),
qui
est
une
miction
souvent
complète
au
rire
[19,24].
Parfois
isolée,
elle
est
dans
un
quart
des
cas
associée
à
une
dysfonction
vésicale
vraie
[25].
Causes
sphinctériennes
Une
autre
cause
de
dysfonction
vésicale
de
remplissage
est
l’instabilité
urétrale.
La
chute
brutale
de
la
pression
uré-
trale
pendant
le
remplissage
va
provoquer
une
contraction
détrusorienne
réflexe
et
une
fuite
urinaire
d’importance
variable.
L’étiologie
de
l’instabilité
urétrale
est
mal
déter-
minée
mais
souvent
liée
à
l’hyperémotivité.
Dysfonctionnement
de
la
phase
de
miction
À
l’inverse
des
anomalies
du
remplissage,
celles
de
la
mic-
tion
sont
plus
souvent
sphinctériennes
que
détrusoriennes.

Troubles
mictionnels
de
l’enfant
213
Cause
sphinctérienne
L’hypertonie
sphinctérienne
résulte
de
mauvaises
habi-
tudes
mictionnelles
(enfants
«
rétentionnistes
»)
ou
d’une
adaptation
du
sphincter
devant
une
CDD.
Elle
induit
un
mauvais
relâchement
périnéal
à
la
miction
qui
majore
les
troubles,
avec
une
augmentation
secondaire
du
tonus
et
de
la
contractilité
détrusorienne,
et
l’apparition
d’un
résidu
post-mictionnel,
véritable
CDD
secondaire.
Causes
détrusoriennes
La
«
vessie
paresseuse
»
(lazy
bladder)
a
une
contractilité
diminuée,
voire
absente,
sans
contraction
détrusorienne
au
relâchement
sphinctérien.
La
sensibilité
vésicale
diminuée
et
l’absence
de
sensation
de
besoin
peuvent
entraîner
des
fuites
par
regorgement.
Cas
particuliers
Irritation
des
organes
génitaux
externes
L’irritation
des
organes
génitaux
externes
(adhérences,
vul-
vites,
dermite
du
siège,
etc.)
peut
entraîner
des
dysuries,
des
brûlures
mictionnelles,
des
pollakiuries
et
des
urgences
mictionnelles
par
l’activation
du
réflexe
mictionnel
[5].
Constipation
L’association
entre
constipation
et
troubles
de
la
miction
est
fréquente
et
peut
relever
de
deux
mécanismes.
Outre
le
risque
d’infection
urinaire,
la
constipation
chronique
pro-
voque
une
activité
anormale
du
sphincter
de
l’urètre
et
du
plancher
pelvien,
et
une
hypocontractilité
détrusorienne
[26].
De
plus,
le
volume
des
selles
dans
le
pelvis
réduit
la
capacité
vésicale
[26].
La
constipation
provoque
alors
une
dysfonction
vésicale
secondaire.
Mais
le
rapport
constipation/dysfonction
vésicale
peut
s’envisager
autrement.
L’exonération
fécale
a
un
méca-
nisme
proche
de
celui
de
la
miction,
certains
muscles
sont
communs
et
les
centres
de
commande
sont
voisins,
voire
communs
(noyau
d’Onufrowicz).
La
constipation
et
le
trouble
mictionnel
font
alors
partie
d’une
pathologie
globale
des
émonctoires
:
le
syndrome
de
dysfonction
éliminatoire
[27].
Certains
adolescents
présentent
aussi
des
troubles
de
l’érection
ou
des
douleurs
génitales.
Quarante
pourcent
des
enfants
constipés
chroniques
ont
des
fuites
d’urines
diurnes
et/ou
nocturnes
qui
sont
améliorées
par
le
traitement
de
la
constipation
[28].
Le
diagnostic
de
constipation
est
retenu
sur
une
fré-
quence
anormale
des
selles,
mais
aussi,
même
avec
une
fréquence
correcte,
sur
la
consistance,
la
douleur
à
l’émission
ou
le
volume
trop
important
[28].
Les
antécédents
de
constipation
dans
la
petite
enfance
sont
à
rechercher.
La
prise
en
charge
utilise
des
régimes
riches
en
fibres,
des
boissons
abondantes
et
des
médications
jusqu’à
obtenir
un
transit
régulier,
indolore
et
quotidien.
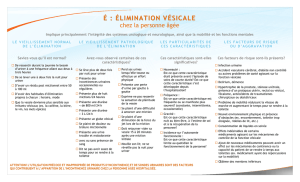
Énurésie
primaire
isolée
L’EnPI
est
une
incontinence
intermittente
exclusivement
pendant
le
sommeil
(notion
familiale
dans
30
%
à
60
%
des
cas).
Il
est
classique
de
distinguer
deux
types
d’EnPI
[3,8]
:
•l’EnPI
polyurique
nocturne
par
inversion
du
cycle
de
l’ADH.
Le
volume
urinaire
nocturne
est
alors
supérieur
au
volume
diurne,
avec
une
osmolarité
(ou
densité)
urinaire
plus
basse
la
nuit
;
•l’EnPI
à
faible
CV,
définie
par
une
CV
fonctionnelle,
éva-
luée
sur
un
calendrier
mictionnel
de
48
heures,
inférieure
à
70
%
de
la
CV
théorique.
Elle
s’accompagne
dans
30
%
des
cas
d’une
hyperactivité
nocturne
du
détrusor.
Cette
classification
sous-estime
le
rôle
du
défaut
d’éveil
nocturne.
En
effet,
ces
deux
mécanismes
expliquent
la
réplétion
vésicale
nocturne
rapide
des
patients,
mais
qui
devrait
provoquer
l’éveil
et
une
miction
consciente
(nyctu-
rie).
L’intensité
de
l’EnPI
peut
être
classée
en
[3]
:
•modérée
(moins
d’un
épisode
par
semaine)
;
•moyenne
(un
ou
deux
épisodes
par
semaine)
;
•sévère
(au
moins
trois
épisodes
par
semaine).
Diagnostic
différentiel
des
troubles
mictionnels
Certaines
fuites
urinaires
ne
sont
pas
des
troubles
miction-
nels
:
•les
incontinences
permanentes,
goutte
à
goutte,
par
abouchements
ectopiques
des
voies
urinaires
(cutané,
rectal,
vaginal,
etc.)
;
•les
pertes
d’urine
après
une
miction
normale,
au
rha-
billage
[19],
qui
évoquent
une
miction
vaginale
chez
la
fille,
favorisée
par
une
miction
«
cuisses
serrées
»,
une
coalescence
des
petites
lèvres
et/ou
une
discrète
ano-
malie
du
méat.
Chez
le
garc¸on,
il
peut
s’agir
de
miction
sous-préputiale
(phimosis
punctiforme
avec
ballonisation
du
prépuce)
ou
d’urine
séquestrée
dans
un
urètre
pénien
plicaturé
dans
les
sous-vêtements
;
•la
pollakiurie
comportementale
[29,30]
avec
20
à
30
mictions
par
jour
sans
fuites
ni
dysuries,
qui
est
un
véritable
«
tic
»
[19]
réactionnel
à
des
troubles
psycho-
sociaux
ou
émotionnels,
ou
à
la
consommation
excessive
de
boissons
acides
(jus
d’orange,
de
pomme,
de
pample-
mousse,
de
raisin,
de
tomate,
etc.)
ou
riches
en
oxalate
(thé,
thé
glacé)
[29,30].
Outre
la
correction
de
ces
mauvaises
habitudes,
une
rééducation
par
biofeedback
peut
être
proposée
dans
les
cas
résistants
[30].
POINT
FORT
Classification
•Les
nouvelles
définitions
doivent
être
utilisées.
Deux
grandes
classes
de
troubles
mictionnels
primitifs
doivent
être
identifiées.
•L’EnPI
est
un
trouble
survenant
exclusivement
pendant
le
sommeil
sans
aucun
signe
diurne.
•Les
dysfonctions
primitives
de
l’élimination
urinaire
regroupent
la
CDD,
l’hypertonie
sphinctérienne
et
l’instabilité
urétrale.

214
E.
Bérard
et
al.
•Les
dysfonctions
vésicales
secondaires
sont
très
sous-
estimées
et
doivent
être
recherchées
avec
soin,
en
particulier
la
constipation.
•Les
autres
causes
de
fuites
urinaires
sans
troubles
mictionnels
doivent
être
éliminées.
•De
nombreux
troubles
non
urinaires
sont
associés
aux
troubles
mictionnels
et
nécessitent
parfois
une
prise
en
charge
spécifique.
Troubles
associés
aux
troubles
mictionnels
Chez
13
%
à
40
%
des
patients
consultant
pour
troubles
mic-
tionnels,
on
retrouve
des
troubles
non
urinaires
associés
chez
l’enfant
et
sa
famille
[2,3],
dont
l’association
est
dif-
ficile
à
interpréter
mais
dépasse
la
simple
coïncidence.
Troubles
psychiques
de
l’enfant
Les
troubles
de
la
miction
peuvent
entraîner
un
repli
sur
soi,
un
stress
émotionnel,
une
perte
de
l’estime
de
soi.
La
baisse
de
l’estime
de
soi
est
fréquente,
avec
des
sentiments
de
honte,
de
culpabilité,
d’humiliation
[31,32].
Le
traitement,
quel
qu’il
soit
et
quel
que
soit
son
résultat,
a
des
effets
positifs
sur
ces
troubles
[32].
Troubles
psychiatriques
Les
enfants
présentant
une
incontinence
urinaire
présentent
deux
à
quatre
fois
plus
de
troubles
du
comportement
[33].
Le
trouble
déficit
de
l’attention
avec
hyperactivité
(TDAH),
présent
chez
3
%
à
5
%
des
enfants
scolarisés,
est
retrouvé
chez
10
%
à
40
%
des
patients
souffrant
de
troubles
mic-
tionnels
[34—36].
Inversement,
chez
les
enfants
consultant
pour
un
TDAH,
21
%
ont
une
énurésie
nocturne
et
6,5
%
des
troubles
diurnes
[36].
Le
traitement
du
TDAH
améliore
sou-
vent
le
trouble
mictionnel
[37].
En
revanche,
Crimmins
et
al.
[38]
montrent
une
moins
bonne
réponse
au
traitement
des
troubles
mictionnels
lorsqu’ils
sont
associés
à
un
TDAH.
L’évaluation
d’un
TDAH
peut
être
faite
par
différents
tests
de
débrouillage
comme
l’ADHD-rating
scale
[39]
et
peut
nécessiter
une
prise
en
charge
spécifique.
Cette
asso-
ciation
fait
suspecter
des
mécanismes
nerveux
centraux
communs
[40].
Troubles
du
développement
et
des
apprentissages
Les
enfants
souffrant
de
troubles
mictionnels
auraient
un
développement
plus
tardif
du
langage
selon
certains
auteurs,
mais
ce
résultat
est
contesté
[1,17,41].
D’autres
études
montrent
une
association
fréquente
de
troubles
mictionnels
avec
des
difficultés
scolaires.
Ces
troubles
d’apprentissage
semblent
plus
fréquents
dans
les
dysfonc-
tions
vésicales
que
dans
les
EnPI
[17,33,40].
Troubles
du
sommeil
Les
apnées
du
sommeil
et
les
parasomnies
sont
fréquentes
chez
les
enfants
souffrant
d’énurésie.
L’enfant
énurétique
a
un
seuil
d’éveil
élevé
aux
stimuli
auditifs
(9,3
%
d’éveil
chez
les
énurétiques
versus
39,7
%
chez
les
témoins)
[42]
et
une
réduction
du
réflexe
de
sursaut
à
la
stimulation
(prepulse
inhibition)
[40].
Troubles
respiratoires
L’étude
de
Stone
et
al.
[43]
met
en
évidence
une
asso-
ciation
entre
troubles
respiratoires
nocturnes
et
énurésie.
L’obstruction
des
voies
aériennes
supérieures
(ronflement),
surtout
si
elle
s’accompagne
d’apnées
obstructives,
est
fré-
quemment
rapportée
dans
l’EnPI
[44].
La
disparition
de
certaines
énurésies
après
amygdalectomie
a
été
signalée
[45].
Troubles
cutanés
Ils
sont
la
conséquence
de
macérations
du
siège
au
contact
de
l’urine
et
peuvent
activer
le
réflexe
mictionnel
[5].
Obésité
Certains
auteurs
ont
suggéré
une
prévalence
plus
grande
de
troubles
mictionnels
(surtout
EnPI)
chez
les
obèses,
avec
une
moins
bonne
réponse
thérapeutique
si
l’indice
de
masse
corporelle
est
supérieur
au
85epercentile
[46].
Troubles
des
relations
sociofamiliales
Le
port
de
couches,
le
lavage
du
linge
et
les
traitements
non
remboursés
représentent
une
charge
pour
les
parents
et
la
famille
[47,48].
Le
trouble
mictionnel
de
l’enfant
induit
aussi
des
modifications
de
la
socialisation
familiale.
Un
tiers
des
enfants
énurétiques
ne
vont
pas
dormir
hors
de
chez
eux
[48]
et
la
moitié
des
parents
ont
un
senti-
ment
d’impuissance
[49],
de
culpabilité
ou
d’échec
éducatif
[48].
Certains
parents
deviennent
intolérants
et
14
%
à
33
%
punissent
l’enfant
[48].
Fréquence
des
troubles
mictionnels
Les
données
épidémiologiques
disponibles
(antérieures
à
la
mise
en
place
des
définitions
de
l’ICCS)
et
la
pratique
font
estimer
que,
parmi
les
enfants
de
six
à
sept
ans,
environ
10
%
à
15
%
ont
des
fuites
nocturnes,
10
%
à
15
%
des
fuites
diurnes
et
5
%
à
10
%
souffrent
des
deux.
Une
enquête
franc¸aise
chez
les
enfants
de
cinq
à
dix
ans
a
révélé
une
prévalence
de
l’EnPI
de
9,2
%
[48]
;
ces
chiffres
sont
similaires
à
ceux
d’études
réalisées
dans
d’autre
pays
[50,51].
L’énurésie
est
secondaire
dans
20
%
à
25
%
des
cas
[50].
L’EnPI
est
plus
fréquente
chez
les
garc¸ons
dans
l’enfance,
mais
cette
tendance
disparaît
à
l’adolescence
[3,51].
En
revanche,
les
troubles
vésicaux
ont
un
sexe
ratio
de
1
[27].
On
estime
que
parmi
les
premières
consultations
pour
troubles
mictionnels
primitifs
il
y
a
deux
tiers
d’EnPI
et
un
tiers
de
dysfonctions
vésicales.
La
fréquence
des
troubles
mictionnels
secondaires
est
sans
doute
sous-estimée,
mais
ils
sont
retrouvés
fréquemment
si
on
les
cherche.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%