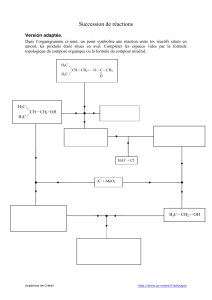
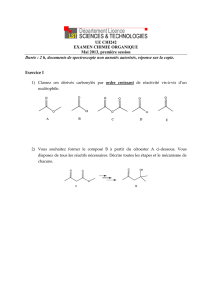
Chimie Organique - Université du Maine

Université du Maine - Faculté des Sciences ⌫ Retour LCU4 – Chimie Organique : Corrigé Janv 2003
Chimie Organique - Corrigé
1.Question de cours :
Les composés carbonylés sont au DO 2
Réactifs AdN Produits DO
1 NH2-NH2, NaOH(conc.) oui R1-CH2-R2 0
2 NaCN, acide oui R1-C(OH)CN-R2 1
3 Zn, HCl non R1-CH2-R2 0
4 C2H5NH2 oui R
1R2C=NH-C2H5 2
5 CH3CH2CH2MgCl puis H2Ooui R
1R2C(OH)C3H8 1
R1
R2
O
R1= R2= Alkyl ou H
6 HOCH2CH2OH, acide sec oui O
O
R1
R2
2
R1 = CH3 7 NaOH, Br2 non R2COONa 3
8 CrO3 non R2COOH 3 R1 = H
9 KOH (concentrée) oui R2COOH + R2CHOH 3 et 1
2. Mécanismes :
Addition électrophile régiosélective (obtention du carbocation le plus stable): on obtient un hémiacetal. Ce composé en milieu
acide, aqueux est en équilibre avec le dérivé carbonylé correspondant et le méthanol
H3C
H3C
H
OCH3
HH3C
H3C
H
OCH3
H
H3C
H3C
H
O-CH3
H
H2OH3C
H3C
H
O-CH3
H
HO
+ H
H3C
H3C
H
O
H
HO H
CH3
un hémiacétal
H3C
H3C
H
O
H
H + H3C
H3C
H
H
OH
CH3OH
+
b) L'acétonitrile est un solvant aprotique, polaire qui favorise la formation du carbocation " benzylique". Ce carbocation se
recombine avec l'anion Br avec racémisation.
H3CBr CH
3CH3H3CBr Br CH3
+
+ Br
Note : hors sujet , on peut remarquer que le produit majoritaire est dans ce cas le produit qui correspond au carbocation le
plus stable= celui qui se forme le plus vite : c'est un contrôle cinétique
c) Cet ester est hydrolysé selon deux mécanismes différents ; c'est la concentration en soude qui " oriente" la réaction vers l'un
ou l'autre mécanisme.

Université du Maine - Faculté des Sciences ⌫ Retour LCU4 – Chimie Organique : Corrigé Janv 2002
• avec la soude concentrée : par sa concentration élevée, la soude intervient dans la vitessse : c'est une réaction BAc2 qui se
fait par attaque du carbone acyle plus réactif que le carbone alkyle. La liason C-O n'étant pas rompue dans ce mécanisme il
y a rétention de configuration
• avec la soude diluée, la concentration faible n'intervient pas cette fois dans la vitesse et il se produit une réaction BAl1 ou
SN1 favorable car on obtient un carbocation à la fois allylique et benzylique stabilisé par mésomèrie. Le produit final
correspond au carbocation le plus stable, le plus conjugué.
O
OH
O
OH
(R)
(R)
(R + S)
Na OH
NaOH/ dilué
OO
(R)
OH
BAc2
SN1
+ RCOONa
+ RCOONa
carbocation le plus
conjugué :
le mieux stabilis
é
d) Le premier produit résulte d'une aldolisation interne d'un cétoaldéhyde en présence d'une base hydroxylée (NaOH, KOH
etc…)
Le second produit résulte d'une réaction de Claisen d'un diester en présence d'éthylate de sodium. (Revoir les mécanismes dans
les cours correspondants : AdN = S8 et SN sur les esters = S10)
COCH3
O
COOEt
COCH3
OH
COCH3
O
O
COOEt
OEt
3. Synthèses
a) Synthèse d'un β-bloquant : Acébutolol: 9
OH
134
OCH3OCH3
NO2
OCH3
NO2
COCH3
2
OCH3
NH2
COCH3
5
OCH3
NHCO(CH2)2CH3
COCH3
6
OH
NHCO(CH2)2CH3
COCH3
7
OCHCH=CH2
NHCO(CH2)2CH3
COCH3
SN SE SE
Réduct. SN Ac.
SN
SN
8
OCHCH-CH2
NHCO(CH2)2CH3
COCH3
HO Cl
*
AdE SN

Université du Maine - Faculté des Sciences ⌫ Retour LCU4 – Chimie Organique : Corrigé Janv 2002
OCHCH-CH2-NH(CH3)3
NHCO(CH2)2CH3
COCH3
HO
9
OCH3
HNO
2
OCH3
HNO
2
*
1) La forme mésomère qui explique la régiosélectivité est écrite ci-dessus.
2) La première réaction sert à bloquer la fonction phénol qui pourrait soit être oxydée par HNO3, soit réagir avec le chlorure
d'acide ensuite.
3) Il y a un carbone asymétrique donc deux stéréoisomères R et S.
b) La séquence réactionnelle suivante a été réalisée dans la synthèse d'un antibiotique : Cyclacilline : 12
COOH
NH2
S
COOH
NH
O
N
H
O
O
O
10 11 1
2
NHCOOH
O
S
COOH
NH
NH2
O
le plus électrophile
1
/
3
100%