Université Louis Pasteur - Strasbourg I

Université Louis Pasteur - Strasbourg I Année 2001-2002
Session de février 2002 UE Optionnelle des Maîtrises « Chimie Organique »
Examen de Chimie Organique
(Epreuve sur le cours du professeur Jean-François Nicoud - durée : 1h30)
***********************************************************************************************************************
Exercice I
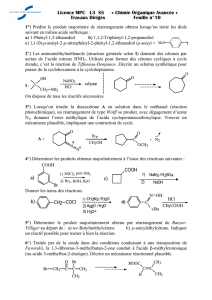
On considère la synthèse de la (R)-(+)-patulolide, lactone macrocyclique à propriété
antibiotique, à partir du 6-bromohexanal, selon le schéma suivant :
O
O
O
Br C O
H
HS SH
Et2O.BF3, 0°C, 24h
A (C9H17BrS2)(75%)
B
2) 3)
Mg/THF/ 60°C
1)
O
CH3
H
NH4Cl
(C12H24OS2)
(70%)
1) protection de l'alcool
2) BuLi, -40°C, 2h
3) DMF, -78°C, 20mn
4) déprotection de l'alcool
C(C13H24O2S2)
(70%)
Ph3PCCO
xylène, ∆, 1h D(non isolé) E(C15H24O2S2)
?(R)-(+)-patulolide
(40%)
(75%)
Le 6-bromohexanal est traité avec du propane-1,3-dithiol en présence d’acide de Lewis pour
donner A (C9H17BrS2). On prépare le réactif de Grignard de A, qu’on fait réagir avec le (R)-
1,2-époxypropane pour conduire, après hydrolyse par NH4Cl aqueux, à l’alcool B noté R-OH.
B est protégé en R-OGP, puis traité par BuLi à froid. On fait réagir le lithien obtenu avec du
DMF à froid, puis on déprotège l’alcool pour obtenir le composé C (C13H24O2S2), qui n’est
autre que B auquel on a greffé une fonction aldéhyde (on rappelle la réaction de formylation
d’un lithien par le DMF : R-Li + DMF → R-CHO). On fait réagir ensuite C avec le cétène-
ylure de phosphore Ph3P=C=C=O. Cela conduit à un ester-ylure D par addition de l’alcool sur
la double liaison C=C du cétène (Ph3P=C=C=O + R-OH → Ph3P=CH−COOR). D n’est pas
isolé mais transformé aussitôt en macrocycle E (C15H24O2S2), puis en composé cherché (R)-
(+)-patulolide.
Questions :
a) Quelle est la structure de A ?
b) Expliquer la formation de l’alcool B. Dessiner sa structure en précisant sa stéréochimie.
c) Expliquer la réaction de formylation de R-OGP. Donner la structure de C.
d) Donner la structure de D.
e) Par quelle réaction obtient-on le macrocycle E ? Donner un mécanisme. Justifier la
formation d’une double liaison E.
f) Donner des conditions de réactions pour passer de E à la (R)-(+)-patulolide dans la
dernière étape.

Exercice II
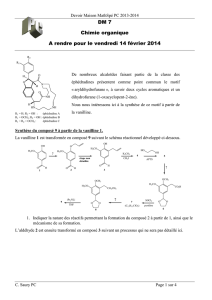
On a préparé des molécules mésogènes (c’est à dire donnant des cristaux liquides) comportant
des motifs aryléthynyles divers. La synthèse de l’une d’entre elles (CL) est schématisée ci-
dessous :
N
Br
N
SiMe3
i
ii
N
H
N
+iii
4
12
3
CL
3
Décrire chacune des réactions i, ii et iii conduisant à CL en précisant les réactifs et catalyseurs
utilisés, et en identifiant le composé 4; donner à chaque fois les conditions de réactions et le
type ou le nom de la réaction (les mécanismes détaillés ne sont pas demandés).
Exercice III
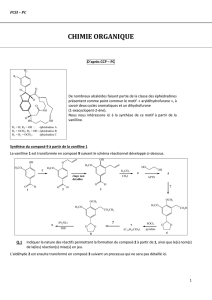
a) En 1976, Stork a décrit la première synthèse totale d’une prostaglandine naturelle à partir
d’un sucre simple, le L-érythrose ou (2S,3S)-(+)-érythrose. Pour débuter la synthèse ce sucre
est transformé en trois étapes en un mélange de deux alcools allyliques épimères A, qu’on
écrira de façon simplifiée selon le schéma encadré ci-dessous :
OO
OH
HH
OCO2CH3
3 étapes
CHOH CHOH CHOHOH2C
A
A=
R
OH
Quels sont les constituants du mélange A ? Les dessiner en suivant la notation simplifiée
encadrée.
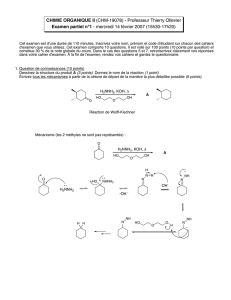
b) Les alcools R-OH, traités par catalyse acide avec du triméthylorthoacétate CH3C(OCH3)3
conduisent à un cétène-acétal suivant la réaction ci-dessous :
ROH +CH3C
OCH3
OCH3
OCH3
HCCH
2
CH3O
RO
On applique cette réaction au mélange A, qui est chauffé à 140°C durant 3 heures en présence
d’un excès de triméthylorthoacétate et de 0,1 équivalent d’acide propanoïque. Par distillation
sous vide on ne récupère pas le mélange de cétène-acétals, mais un produit de réarrangement
thermique B unique (R*−C6H9O2), avec 83 % de rendement.
Quel est le type de réarrangement effectué ? En déduire la structure du produit B . Le
dessiner en précisant sa stéréochimie. Montrer, avec l’aide de dessins des états de transition
admis pour ce type de réarrangement, que les constituants du mélange A conduisent bien au
même produit B.
1
/
2
100%