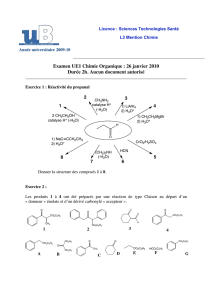
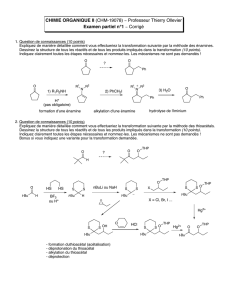
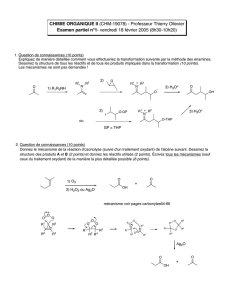
3 H

Br CO
2
C
2
H
5
Ph
3
PCO
2
C
2
H
5
O
R
+
Ph
3
P CO
2
C
2
H
5
C
2
H
5
O
2
C
R
+
Ph
3
P O
1) PPh
3
2) NaH
Ph
3
P CO
2
C
2
H
5
Ylure de phosphonium
Oxyde de triphénylphosphine
DEVOIR SURVEILLÉ DE SCIENCES PHYSIQUES N° 7 (3 H)
Synthèse organique d'une molécule bioactive
Afin de simplifier l’écriture des formules chimiques, les doublets non liants n’ont pas été
représentés sur le dessin des molécules. Cependant, les mécanismes demandés devront être écrits
avec des formules de Lewis correctes, la totalité des doublets non liants devant être représentée.
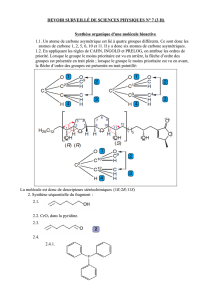
La (+)-muconine est un antitumoral pour les poumons et le pancréas. Cette molécule possède la
structure suivante :
O
C
12
H
25
OH
H H
O
HH
OH
5
OH
O
O
1
2
3 4
5 6
7
8
9
10
11
12
Pour la suite, on s’intéressera plus particulièrement au fragment entre crochets.
1. Stéréochimie :
1.1. Combien y-a-t-il d’atomes de carbone asymétriques (centres stéréogènes) dans le
fragment considéré ?
1.2. Donner les configurations absolues (descripteurs stéréochimiques) des atomes de
carbone C-1, C-2 et C-11 du fragment. Justifier.
2. Synthèse séquentielle du fragment :
La première étape consiste en l’oxydation ménagée du hex-5-èn-1-ol par le chlorochromate
de pyridinium (PCC). Le composé 2 est ensuite engagé dans une réaction dite de Wittig (que l’on va
détailler ci-après) pour donner le composé 3 :
hex-5-èn-1-ol PCC 2 C
6
H
10
OPh
3
P=CHCO
2
C
2
H
5
CH
2
Cl
2
CO
2
C
2
H
5
3
2.1. Donner la formule semi-développée du hex-5-èn-1-ol.
2.2. Donner un réactif analogue au PCC pour effectuer l’oxydation ménagée d’un alcool.
2.3. Donner la structure du produit 2.
2.4. La réaction de passage du composé 2 au composé 3 est une réaction de Wittig, dont le
schéma réactionnel est le suivant :

O O O
O O
La première étape permet d’obtenir un ylure de phosphonium à partir de la
triphénylphosphine (PPh 3) et d’un dérivé halogéné, en présence de l’hydrure de sodium NaH, qui
joue ici le rôle d’une base forte. L’ylure effectue ensuite une addition nucléophile sur le composé
carbonylé, formant ainsi un composé zwittérionique qui se cyclise en oxaphosphétane (hétérocycle
de 4 atomes). Ce dernier se décompose en alcène et oxyde de triphénylphosphine.
2.4.1. Dessiner la formule de Lewis de la molécule de triphénylphosphine PPh3 .
Quel type de réactivité présente l’atome de phosphore ? Justifier.
2.4.2. Proposer un mécanisme pour l’obtention de l’ylure de phosphonium.
2.4.3. En s’appuyant sur le schéma réactionnel indiqué et en suivant l’énoncé,
proposer un mécanisme pour la transformation 2 3.
3. Le composé 3 est ensuite réduit par le tétrahydruroborate de sodium NaBH 4 pour donner le
composé 4, dont la fonction alcool est protégée par l’oxyde de di-tert-butylcarbonate Boc2O, de
formule semi-développée suivante :
Le schéma réactionnel est ainsi le suivant :
3NaBH
4
4Boc
2
O
OBoc
5
toluène, 0°C toluène
Donner la structure du composé 4.
4. Le composé 5 est ensuite transformé selon le bilan suivant :
4.1. Quelle est la fonction chimique formée dans le composé 6 ?
4.2. Proposer une méthode d’obtention de 6.
5. Le composé 6 est ensuite traité par l’ozone en milieu réducteur pour donner le composé 7.
Ce dernier subit une addition nucléophile de l’alcynure obtenu par déprotonation de l’alcyne
terminal A à l'aide de la base forte CH3(CH2)2CH2Li (BuLi) :
Sachant que la première étape décrit la formation de l’alcynure par action de la base forte
BuLi sur l’alcyne, proposer un mécanisme pour le passage du composé 7 au composé 8.
Boc2O
Boc
5
OBoc
O
6
61) O
3
, CH
3
OH
2) Zn / CH
3
CO
2
H
7
(H
3
C)
3
Si
BuLi (1eq.), -78°C
(H
3
C)
3
Si
OH
OBoc
O
8
1) A :
2) H
2
O, H
+

11
O O
O
H H
12
OH
HO
6. Le composé 8 est transformé en 9 par une suite réactionnelle que nous ne détaillerons pas ici.
Le composé 9 réagit ensuite avec un équivalent d’acétone (propanone) en présence d’acide
paratoluène sulfonique (APTS) pour donner le composé 10. Ce dernier est enfin hydrogéné sur
palladium de Lindlar et donne le composé 11.
O OH
OH
H H
9
10 H
2
, Pd Lindlar
11
C
12
H
18
O
3
acétone, APTS
O O
O
H H
6.1. Donner la structure du composé 10. Comment appelle-t-on la nouvelle fonction
obtenue ?
6.2. Donner le mécanisme de la transformation 9 10.
6.3. Le passage du composé 10 au composé 11 consiste en l’hydrogénation ménagée de la
fonction alcyne sur le catalyseur de Lindlar, qui est dit « empoisonné ». Proposer une définition de
ce qu’est un catalyseur « empoisonné ». Qu’aurait-on obtenu avec un catalyseur « non
empoisonné » ?
7. Le composé 11 est ensuite transformé en 12 selon le bilan suivant :
Proposer une méthode d’obtention de 12, sachant qu'une série de trois réactions est attendue.
8. Une des fonctions alcool du composé 12 est ensuite activée par le chlorure de tosyle (TsCl),
pour former sélectivement le composé 13, qui réagit avec un équivalent d’hydrure de sodium NaH
pour donner le composé 14 :
12 13 NaH, THF
O O
O
H H
14
O
TsCl
8.1. Justifier en quoi une molécule de TsCl, en présence de pyridine, peut activer une
fonction alcool.
8.2. Donner la structure du composé 13 obtenu, en utilisant la structure de 14.
8.3. Sachant que l’hydrure de sodium NaH agit ici comme une base, proposer un mécanisme
pour la transformation 13 14.
9. Le composé 14 est ensuite traité par un organomagnésien pour former le composé 15, puis 15
subit une ozonolyse en milieu réducteur pour donner le composé 16. Ce dernier est engagé dans une

réaction de Wittig pour former 17, qui traité par le tétrahydruroaluminate de lithium LiAlH 4 donne
finalement le composé 18 :
9.1. Sachant que l'organomagnésien se comporte comme un carbanion,
déterminer le mécanisme du passage du composé 14 au composé 15, en justifiant la régiosélectivité
de l’attaque.
9.2. En s'inspirant du bilan 6 --> 7 donner la structure du composé 16.
9.3. En vous appuyant sur les développements de la question 2.4., justifier l’obtention du
composé 17.
9.4. Si l’on souhaitait poursuivre la synthèse, comment pourrait-on détruire le cétal cyclique
à 5 atomes de 18 pour obtenir un diol ?
RENDEMENT D'UNE RÉACTION STÉRÉOSÉLECTIVE
La réduction du d-(+)-camphre en présence de borohydrure de sodium permet d'obtenir apriori
deux stéréoisomères:
14 15 C
15
H
26
O
4
1) O
3
, CH
3
OH
2) (CH
3
)
2
S16
MgBr
1)
2) H
2
O, H
+
17
LiAlH
4
O O
O
H H
18
OH
HO
Ph
3
P
CO
2
C
2
H
5
16
C
2
H
5
O
2
C
OH
O
H H
O
O

1) Quel est le type de stéréoisomérie qui existe entre les produits ci-dessus?
2)
2.1. La réaction ci-dessus est effectuée en présence d'un excès de borohydrure de sodium;
quel est l'effet recherché?.
2.2. Une fois la réaction terminée on rince la poudre obtenue par de l'eau pour éliminer
les composés à base de bore. Comment effectue-t-on ce rinçage?
2.3. On dissout 0,5 g de poudre de produits obtenus dans 25 cm3 d'alcool; la solution
obtenue est versée dans une cuve de polarimètre de 20 cm de long et on mesure un
pouvoir rotatoire de -0,5 °. En déduire le pouvoir rotatoire spécifique de la solution ainsi
que les pourcentages molaires de chacun des produits en supposant que l'effet recherché
dans le 2.1. est obtenu. Pourquoi peut-on qualifier cette réaction de stéréosélective?
Données: C: 12 g.mol-1 H: 1 g.mol-1 O: 16 g.mol-1
Pouvoirs rotatoires spécifiques:
d-(+)-camphre: [α d(+)-camphre = 43 ° g-1.cm3.dm-1
d-(-)-isobornéol: [α d(-)-isobornéol =-34,3 ° g-1.cm3.dm-1
d-(+)-bornéol: [α d(+)-bornéol =37,7 ° g-1.cm3.dm-1
2.4. Un manipulateur effectue la chromatographie sur couche mince du produit obtenu sur
silice et obtient trois tâches après révélation: dire à quelles hauteurs relatives se situent
ces tâches et expliquer pourquoi. La valeur du pouvoir rotatoire précédent peut alors être
interprétée différemment: le manipulateur néglige la formation de produit minoritaire et
suppose qu'il reste du camphre, en déduire un ordre de grandeur du rendement de la
réaction en faisant cette hypothèse.
2.5. Pour améliorer le rendement, un manipulateur décide de laisser la réaction de
réduction du d(+)-camphre se produire plus longtemps que dans le cas précédent, il
mesure en fin de réaction un pouvoir rotatoire d'environ 0°. Comment cela s'explique-t-
il?
1
/
5
100%