exercices chimie organique pour s`entrainer

1
PCSI – PC
CHIMIE ORGANIQUE
D’après CCP – PC
O
O
N
O
NH
HN NH
R2
H
H
H
R1
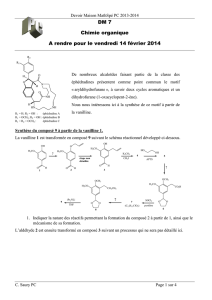
R1 = H; R2 = OH : éphédradine A
R1 = OCH3; R2 = OH : éphédradine B
R1 = R2 = OCH3 : éphédradine C
De nombreux alcaloïdes faisant partie de la classe des éphédradines
présentent comme point commun le motif « aryldihydrofurane », à
savoir deux cycles aromatiques et un dihydrofurane
(1-oxacyclopent-2-ène).
Nous nous intéressons ici à la synthèse de ce motif à partir de la
vanilline.
Synthèse du composé 9 à partir de la vanilline 1
La vanilline 1 est transformée en composé 9 suivant le schéma réactionnel développé ci-dessous.
OH
H3CO
O H
1
O
H3CO
O H
2
OH
H3CO
O H
3
K2CO3
CH3I45
CO2H
OCH3
H3CO
6
?
étape non
détaillée
?
HO OH
APTS
O O
SOCl2
7
8
CO2CH3
OCH3
H3CO
O O ?
iPr2NLi
9THF pyridine
(C13H15ClO5)
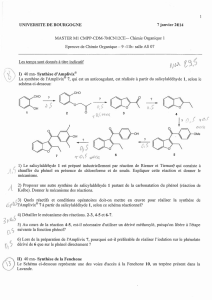
Q.1 Indiquer la nature des réactifs permettant la formation du composé 2 à partir de 1, ainsi que le(s) nom(s)
de la(les) réaction(s) mise(s) en jeu.
L’aldéhyde 2 est ensuite transformé en composé 3 suivant un processus qui ne sera pas détaillé ici.

2
On traite ensuite 3 par l’iodométhane en présence de carbonate de potassium.
Q.2 Donner la formule topologique du composé 4 obtenu.
Le composé 4 est ensuite traité en présence d’éthane-1,2-diol et d’acide para toluène sulfonique (APTS) pour
conduire à 5.
Q.3 Donner la formule topologique de 5. Pas encore traité : regarder le corrigé.
[…]
Obtention du motif « aryldihydrofurane ».
Le composé aryldihydrofurane 15 est obtenu suivant la suite de réactions détaillée ci-dessous.
OCH3
Br
H3CO
O
HO
HO
O
O
CH3SO2Cl, Et3N
LiBr
tBuOK
OOCH3
CO2CH3
HO
O
O
(C22H26O8)(C22H25BrO7)
11
14
12 13 étapes non
détaillées
91- 10
2- H2O
15
DMSO
tBuOH
12
3
4
5
Le composé 11 est mis en présence de chlorure de mésyle (CH3SO2Cl) et de triéthylamine pour conduire à 12.
Q.4 Donner la formule topologique de 12.
Le composé 12, traité par une solution de LiBr dans le diméthylsulfoxide (DMSO) conduit à 13.
Q.5 Donner la formule topologique de 13 (C22H25BrO7).
Le composé 13 est transformé en composé 14 suivant des étapes non étudiées ici.
Le dérivé bromé 14 traité par le tert-butylate de potassium comme base conduit à 15.
Q.6 Proposer un mécanisme pour cette transformation, sans tenir compte de la stéréosélectivité observée.
11

3
D’après ENS – PC – 2014
Synthèse stéréocontrôlée du Trichodermatide A
En 2008, Pei et ses collaborateurs ont identifié dans certains champignons marins (Trichoderma ressei) une
molécule possédant une importante activité cytotoxique à l’encontre des cellules de mélanomes humains (tumeurs
de la peau). Ce composé, le Trichodermatide A, possède la formule ci-dessous [la numérotation des atomes est
celle donnée dans l’article original] :
Cette activité anti-cancéreuse a conduit le chimiste japonais Hiroya et ses collaborateurs à élaborer une voie de
synthèse rapide et stéréocontrôlée du Trichodermatide A.
La stratégie de synthèse retenue est organisée autour de trois séquences :
Séquence 1 : la transformation de l’acide tartrique [1] en un aldéhyde chiral [9]
Séquence 2 : la formation du système pentacyclique
Séquence 3 : la fonctionnalisation du polycycle pour obtenir le Trichodermatide A
L’objet de cette partie est l’étude d’une partie de la séquence 1.
Le travail de ce groupe est paru dans la revue Angewandte Chemie, 2013, 52, 3646-3649.
Transformation de l’acide tartrique en aldéhyde chiral
La première étape de la séquence, indiquée dans le dessin ci-dessous, est la formation d’un cétal [3] avec le
2,2-diméthoxypropane à partir de l’ester diméthylique de l’acide tartrique [2], en présence d’acide
para-toluènesulfonique (APTS = CH3C6H4SO3H).
La fixation de la chaîne carbonée est réalisée en deux étapes à partir du diol [4].

4
Q.7 La première étape est une ditosylation du diol [4]. Quel est l’intérêt de cette étape ?
Q.8 La deuxième étape est la réaction du ditosylate [5] avec un réactif de GRIGNARD (organomagnésien mixte).
Proposer une formule brute pour l’organomagnésien mixte R-MgBr. Nommer la réaction mise en jeu
dans cette étape [5] → [6].
La transformation du monotosylate [6] en aldéhyde [9] s’effectue en 3 étapes :
Q.9 Écrire l’équation de la réaction modélisant la transformation [6] [7]. Nommer la réaction de formation
de [7] à partir du tosylate [6] ?
Q.10 Donner le mécanisme de cette réaction. Préciser les principales caractéristiques de ce mécanisme. Quel
est l’intérêt d’utiliser le DMF, solvant polaire ( = 38) et aprotogène ?
La transformation de [7] en [8] fait intervenir un réactif de GRIGNARD puis [8] est transformé en [9] au moyen d’une
ozonolyse.
Q.11 Proposer une écriture topologique du réactif de GRIGNARD employé dans la transformation [7] [8].
Q.12 Donner la structure de Lewis de la molécule d’ozone (O3), préciser les formes mésomères possibles de la
molécule. Cette molécule possède un moment dipolaire de 0,49 D. Expliquer.

5
Correction
CCP – PC
Q.1
Q.2
Q.3
Q.4
Q.5
Q.6
 6
6
1
/
6
100%