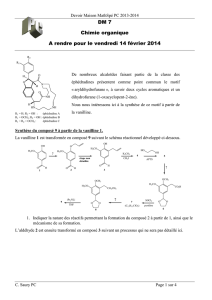
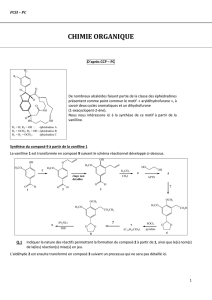
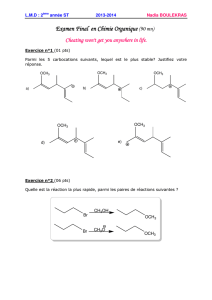
réactions en chaînes - Université Kasdi Merbah Ouargla

1
Université Kasdi Merbah Ouargla
Faculté des Sciences et de la Technologie et Sciences de la Matière
Département de Génie des Procédés
3eme année LMD Génie des Procédés
Module : Cinétique Chimique (2010/2011)
TD : RÉACTIONS EN CHAÎNES
EXERCICE N1:
L'hydrogénation de l'éthylène en présence de vapeurs de mercure, se fait selon l'équation
stœchiométrique:
C2H4 + H2 C2H6
Expérimentalement, on observe que la vitesse de formation de l'éthane est de la forme:
V= k apparent [C
2
H
4
] [Hg]
1/2
[H
2
]
1/2
Pour expliquer ce résultat, le mécanisme suivant a été proposé:
H H 2
H C H HC
HC H HC
2H Hg H Hg
2
K
62
K
252
52
K
42
K
2
4
3
2
1
H
Montrer que le mécanisme proposé conduit à une expression de la vitesse d'apparition du produit qui est en accord
avec le résultat expérimental.
EXERCICE N2:
Soit la réaction de synthèse du bromure d'hydrogène :
2HBr Br H 22
On montre expérimentalement que la loi expérimentale de vitesse est de la forme : Le mécanisme proposé est le
suivant :
M Br M Br 2
BrH HBr H
Br HBr Br H
H HBr H Br
M 2Br M Br
2
K
2
K
K
2
K
2
K
2
5
4
3
2
1
-
Donner l'expression de la vitesse de formation de l'acide bromhydrique.
-
Comment varie cette vitesse au cours du temps.

2
EXERCICE N 3:
La pyrolyse du propanal peut être induite à 500°K par l'addition d'une petite quantité de peroxyde
R-O-O-R- Le schéma réactionnel proposé est :
6242
K
52
5262
K
5252
52
K
52
52
K
52
K
HCHC H2C
COHCHCCHOHCHC
HCCO COHC
COHCROH CHOHCRO
2RO ROOR
5
4
3
2
1
1°) En faisant l'hypothèse de l'état quasi-stationnaire, établir l'expression de la vitesse de disparition du
propanal,
2°) Expérimentalement, cette vitesse se traduit par la relation :
0.5
52 CHO][ROOR]Hk[Cv
3°) Comparer avec l'expression obtenue au (1°). En déduire l'énergie d'activation de la réaction (1), sachant que
l'énergie d'activation expérirnentale est de 28 Kcal/mole et que (Ea4-1/2Ea5)=10 Kcal /mole.
EXERCICE N 4:
Thermolyse de I'éthanal
On étudie, en phase gazeuse, la thermolyse de l'éthanal, dont un bilan approximatif peut s'écrire :
CH3CHO CH4CO+
Le mécanisme propose est le suivant:
CH3CHO k1CH3 + CHO
CHO k2H
H
CO
CO
+
CH3CHO
+k3H2+CH3CO
CH3CO
CH3CO
k4CH3+
CH3CH3CHO
+k5CH4+
2 CH3k6C2H6
(1)
(3)
(4)
(5)
(6)
(2)
a. Quelles sont les phases d'initiation et de rupture ?
b.
Montrer que Ton ne peut pas retrouver le bilan simplifies a I'aide du mécanisme.
c.
Quel est le maillon de
la
réaction en chaîne ? Quel est son bilan ? Identifier les porteurs de chaîne.
En déduire quels sont pour ce mécanisme : les produits principaux, les produits secondaires dits aussi
mineurs.
d. Établir ('expression de la concentration des intermédiaires en fonction de la concentration du
réactif et des différentes constantes en appliquant le principe de l'état quasi stationnaire.
e. Quelle est la seule façon simple de définir la vitesse de réaction ? En déduire I'expression de la
vitesse de la réaction et les expressions des vitesses de formation des différents produits ;
conclure.
f. Que se passe-t-il si la chaîne est longue soit k1 << ki ?

3
EXERCICE N 5:
On étudie la réaction de formation de CCl
4
selon le bilan:
4
K
23 CClHClClCHCl
On propose le mécanisme suivant :
4 MCl M2Cl
3 ClCCl ClCCl
2 CClHCl CHClCl
1 M2Cl MCl
2
K
4
K
23
3
K
3
K
2
4
3
2
1
a.
Exprimer cette vitesse en appliquant le principe de I'état stationnaire aux espèces intermédiaires (molécules et
radicaux libres).
b. En déduire l'énergie d'activation globale de la réaction en fonction des énergies d'activation Ei pour les réactions
élémentaires.
EXERCICE N 6:
La pyrolyse du dimethyl ether suit le schéma suivant :
Ki est la constante de vitesse de chaque acte élémentaire.
1. Ecrire l’équation générale de la réaction globale de la pyrolyse du dimethyl ether.
2. Déterminer l’expression de la vitesse de formation de CH4
62
K
33
232
K
33
2
K
3
32
K
32
324
K
333
33
K
33
HC CHCH
HOCHCH OCHCHH
OCHH OCH
CHOCH OCHCH
OCHCHCH OCHCHCH
OCHCH OCHCH
5
5
4
3
2
1
1
/
3
100%