Merck annonce les résultats positifs d`une étude évaluant le

Communiqué de presse
_______________________________________________________________________________________
Relations avec les
médias :
Annick Robinson
Merck Canada
438-837-2550
Relations avec les
investisseurs :
Joseph Romanelli
908-423-5185
Stephanie Lyttle
Cabinet de relations
publiques NATIONAL
514-843-2365
Justin Holko
908-423-5088
Merck annonce les résultats positifs d’une étude évaluant le
pembrolizumab, comparativement à la chimiothérapie, chez des patients
atteints d’une forme avancée de mélanome réfractaire à l’ipilimumab
Le pembrolizumab s’est avéré supérieur à la chimiothérapie à l’égard du paramètre principal de
survie sans progression
Résultats présentés pour la première fois au congrès international 2014 de la Society of
Melanoma Research (SMR) tenu à Zurich, en Suisse, du 13 au 16 novembre 2014
Kirkland (Québec), le 16 novembre 2014 – Merck, connue sous le nom de MSD à l’extérieur du
Canada et des États-Unis, a annoncé aujourd’hui les résultats positifs d’une étude évaluant l’emploi du
pembrolizumab, comparativement à la chimiothérapie, chez des patients atteints d’une forme avancée
de mélanome réfractaire à l’ipilimumab.
D’après une analyse prédéterminée des données tirées d’une étude pivot de phase 2
(KEYNOTE-002), le pembrolizumab, soit le traitement anti-PD-1 expérimental de l’entreprise, a
entraîné une amélioration substantielle du paramètre principal de survie sans progression (SSP,
conformément à une évaluation centralisée réalisée en fonction des critères RECIST 1.1) (RR de 0,57
et de 0,50 pour les doses de 2 mg/kg et 10 mg/kg administrées toutes les trois semaines,
respectivement), comparativement à la chimiothérapie (p < 0,0001 pour les deux comparaisons), chez
des patients atteints d’une forme avancée de mélanome réfractaire à l’ipilimumab (n = 540). Après six
mois, les taux de SSP observés avec le pembrolizumab étaient de 34 % pour la dose de 2 mg/kg (IC à
95 % : 27 à 41) (n = 180) et de 38 % pour la dose de 10 mg/kg (IC à 95 % : 31 à 45) (n = 181),
comparativement à 16 % pour la chimiothérapie (IC à 95 % : 10 à 22) (n = 179). Au moment de
l’analyse provisoire, la durée médiane du suivi était de 10 mois.

- 2 -
Ces résultats, y compris ceux des analyses prédéterminées du taux de réponse globale (TRG),
de la durée de la réponse, de l’innocuité et de la qualité de vie liée à la santé (QVLS), ont été présentés
aujourd’hui par le Dr Antoni Ribas, professeur d’hémato-oncologie et de chirurgie et directeur du Tumor
Immunology Program du Jonsson Comprehensive Cancer Center de l’Université de Californie, à Los
Angeles, dans le cadre d’une présentation orale effectuée pendant le congrès international 2014 de la
Society of Melanoma Research (SMR) tenu à Zurich, en Suisse.
« Ces résultats montrent que le pembrolizumab s’est avéré supérieur à la chimiothérapie, et
qu’il a permis à un plus grand nombre de patients atteints d’une forme avancée de mélanome
réfractaire à l’ipilimumab de bénéficier d’une survie sans progression », explique le Dr Eric Rubin, vice-
président du développement clinique en oncologie, Laboratoires de recherche Merck. « Les données
comparatives sur l’efficacité et l’innocuité tirées de l’étude pivot KEYNOTE-002 permettent de valider et
d’étendre les résultats de l’étude menée antérieurement dans cette population de patients difficiles à
traiter, et nous espérons présenter les données sur la survie globale dans un prochain congrès. »
Dans l’analyse prédéterminée de la SSP, aucune différence significative n’a été observée entre
les doses de pembrolizumab (RR de 0,91, intervalle de 0,71 à 1,16) (p < 0,44). Les résultats d’une
évaluation de la SSP effectuée par l’investigateur se sont avérés comparables à ceux de l’évaluation
centralisée. De plus, on a observé une amélioration de la SSP avec le pembrolizumab dans tous les
sous-groupes prédéterminés. L’analyse prédéterminée avait pour objectif d’évaluer la supériorité de
l’une ou l’autre des doses de pembrolizumab, par rapport à la chimiothérapie, sur le plan de la SSP
(évaluation réalisée après ≥ 270 cas de SSP à un seuil de signification de 0,25 %) (valeur unilatérale)
(RR estimé de 0,66). Le plan de l’étude comprenait deux co-paramètres principaux, la SSP et la survie
globale. Une évaluation de la survie globale doit être réalisée, en 2015, dans le cadre de l’analyse
prédéterminée finale.
Données supplémentaires sur l’efficacité et l’innocuité tirées de l’étude KEYNOTE-002
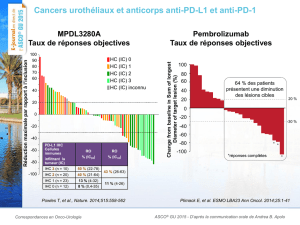
Les taux de réponse globale (confirmés) associés au pembrolizumab étaient cinq à six fois plus
élevés, comparativement à ceux observés avec la chimiothérapie. Le TRG était de 21 % avec le
pembrolizumab à 2 mg/kg (IC à 95 % : 15 à 28) et de 25 % avec le pembrolizumab à 10 mg/kg (IC à
95 % : 19 à 32), comparativement à 4 % avec la chimiothérapie (IC à 95 % : 2 à 9) (p < 0,0001 pour les
deux comparaisons). Au moment de l’analyse prédéterminée, la durée médiane de la réponse n’avait
pas été atteinte avec le pembrolizumab, et des réponses soutenues confirmées étaient observées chez
92 % des patients recevant la dose de 2 mg/kg (intervalle de ≥ 6 à ≥ 50) et chez 87 % de ceux recevant
la dose de 10 mg/kg (intervalle de ≥ 5 à ≥ 48). La durée médiane de la réponse était de 37 semaines
dans le groupe recevant la chimiothérapie, et 63 % des patients présentaient une réponse soutenue

- 3 -
(intervalle de ≥ 7 à 41). Aucune différence significative n’a été observée quant au TRG ou à la durée de
la réponse entre les deux doses de pembrolizumab (p = 0,21).
Dans une analyse exploratoire prédéterminée de la QVLS, les patients traités avec le
pembrolizumab ont rapporté une diminution significativement inférieure du score de l’état de santé/la
qualité de vie, comparativement à ceux recevant une chimiothérapie (d’après le questionnaire QLQ-
C30 de l’EORTC [European Organization for Research and Treatment of Cancer (EORTC) Core
Quality of Life Questionnaire]). La variation moyenne, par rapport aux valeurs initiales, observée à la
semaine 12 (selon la méthode des moindres carrés) avec le pembrolizumab, comparativement à la
chimiothérapie, était de 6,52 (p = 0,011) pour la dose de 2 mg/kg et de 6,57 (p = 0,009) pour la dose de
10 mg/kg.
L’incidence des effets indésirables correspondait aux données rapportées antérieurement pour
le pembrolizumab. Malgré la plus longue durée du traitement (médiane), l’incidence des effets
indésirables reliés au traitement de grade 3 à 5 était inférieure avec le pembrolizumab à 2 mg/kg
(11 %) et à 10 mg/kg (14 %), comparativement à la chimiothérapie (26 %). Des effets indésirables
graves reliés au traitement ont été observés avec le pembrolizumab à 2 mg/kg (8 %) et à 10 mg/kg
(11 %) ainsi qu’avec la chimiothérapie (10 %). Des effets indésirables à médiation immunitaire de
grade 3, y compris une hépatite (n = 3), une colite (n = 2), une pneumonite (n = 3), une hypophysite
(n = 1) et une iritis ou une uvéite (n = 1), ont été observés avec toutes les doses de pembrolizumab.
Aucun effet indésirable à médiation immunitaire de grade 4/5 n’a été rapporté. Au total, 3 %, 7 % et
6 % des patients recevant le pembrolizumab à 2 mg/kg, le pembrolizumab à 10 mg/kg et une
chimiothérapie, respectivement, ont abandonné le traitement en raison d’effets indésirables reliés au
traitement et évalués par l’investigateur. Un seul décès relié au traitement a été rapporté avec le
pembrolizumab, et aucun décès n’a été signalé dans le groupe recevant la chimiothérapie.
À propos de l’étude KEYNOTE-002
KEYNOTE-002 est une étude pivot internationale de phase 2 avec répartition aléatoire
(n = 540) visant à évaluer le pembrolizumab à 2 mg/kg (n = 180) et à 10 mg/kg (n = 181) administré
toutes les trois semaines, comparativement à une chimiothérapie choisie par l’investigateur (n = 179)
(paclitaxel plus carboplatine, paclitaxel, carboplatine, dacarbazine ou témozolomide), chez des patients
atteints d’une forme avancée de mélanome réfractaire à l’ipilimumab. Dans l’étude, 83 % des patients
étaient atteints d’un mélanome au stade le plus avancé (M1c), et 73 % des patients avaient reçu au
moins deux traitements à action générale antérieurs, y compris l’ipilimumab. Les co-paramètres
principaux de l’étude étaient la SSP et la survie globale. Le TRG, la durée de la réponse et l’innocuité
constituaient les paramètres secondaires. La QVLS représentait quant à elle un paramètre exploratoire

- 4 -
prédéterminé. La réponse tumorale était évaluée à la semaine 12, puis toutes les six semaines jusqu’à
la semaine 48. Elle était ensuite évaluée toutes les 12 semaines au moyen d’une évaluation centralisée
indépendante effectuée par radiographie et à l’insu, conformément aux critères RECIST 1.1 (Response
Evaluation Criteria in Solid Tumors). Les patients recevant une chimiothérapie et présentant une
maladie évolutive, déterminée au moyen d’une évaluation centralisée menée à l’insu, pouvaient passer
dans l’un des deux groupes traités avec le pembrolizumab après trois mois.
À propos du pembrolizumab
Le pembrolizumab est un anticorps monoclonal humanisé qui bloque l’interaction entre le PD-1
et ses ligands, le PD-L1 et le PD-L2. En se liant au récepteur PD-1 et en bloquant l’interaction avec ses
ligands, le pembrolizumab lève l’inhibition de la réponse immunitaire médiée par le PD-1, y compris la
réponse immunitaire antitumorale.
Notre intérêt pour le cancer
Notre objectif est de traduire les percées scientifiques en innovations biomédicales pour aider
les personnes atteintes du cancer partout dans le monde. Chez Merck Oncologie, aider à lutter contre
le cancer est une passion, favoriser l’accès à nos médicaments contre le cancer est un engagement et
poursuivre la recherche en immuno-oncologie est un idéal pour apporter de l’espoir aux personnes qui
sont atteintes d’un cancer.
Au Canada, le mélanome est la forme la plus grave de cancer de la peau1 et l’un des rares
cancers dont l’incidence chez les Canadiens continue d’augmenter, des hausses récentes de 2,2 % par
année ayant été observées chez les hommes entre 2001 et 2010,et de 2,6 % par année chez les
femmes entre 2003 et 2010. En 2014, on estime à 6 500 le nombre de nouveaux cas de mélanomes
cutanés malins qui seront diagnostiqués.
Pour obtenir un complément d’information sur nos essais cliniques en oncologie, visitez le site à
l’adresse www.merck.com/clinicaltrials.
À propos de Merck
La société Merck d’aujourd’hui est un chef de file mondial dans le domaine des soins de santé qui
œuvre au bien-être du monde. Merck est connue sous le nom de MSD à l’extérieur du Canada et des
États-Unis. Grâce à nos médicaments d’ordonnance, nos vaccins et nos traitements biologiques de
même qu’à nos produits de santé grand public et de santé animale, nous collaborons avec nos clients
et œuvrons dans plus de 140 pays à procurer des solutions de santé novatrices. Nous démontrons
également notre détermination à améliorer l’accès aux soins de santé grâce à des politiques,

- 5 -
programmes et partenariats d’envergure. Pour obtenir un complément d’information sur nos activités au
Canada, visitez le site à l’adresse www.merck.ca.
Déclarations prospectives
Ce communiqué contient des « déclarations prospectives » (forward looking statements), au sens des
dispositions libératoires de la Private Securities Litigation Reform Act of 1995 des États-Unis. Ces
déclarations sont fondées sur les convictions et les prévisions actuelles de la direction de Merck et sont
soumises à de nombreux risques et incertitudes. Aucune garantie ne peut être accordée quant à
l’obtention des approbations réglementaires nécessaires à l’homologation ou à l’éventuel succès
commercial des produits en phase de mise au point. Si les hypothèses sous-jacentes se révèlent
inexactes ou si les risques et incertitudes se matérialisent, les résultats réels pourraient différer
substantiellement de ceux annoncés dans les déclarations prospectives.
Ces risques et incertitudes comprennent, sans s’y limiter, les conditions générales de l’industrie
et la concurrence, les facteurs économiques généraux, incluant les fluctuations des taux d’intérêt et des
taux de change; les effets de la réglementation de l’industrie pharmaceutique ou des lois concernant
les soins de la santé aux États-Unis et dans le monde; les tendances mondiales à l’égard de la
limitation des coûts des soins de santé; les avancées technologiques et les nouveaux produits et
brevets des concurrents; les défis liés à l’élaboration d’un nouveau produit, ce qui inclut l’obtention de
l’approbation réglementaire; la capacité de Merck à prédire précisément les conditions de marché
futures; les difficultés ou les retards de fabrication; l’instabilité financière des économies mondiales et le
risque de souveraineté; la dépendance à l’égard de l’efficacité des brevets de Merck et des autres
protections relatives aux produits innovants; et le risque de faire l’objet d’actions judiciaires ou de
mesures réglementaires.
Merck n’est pas tenue de publier des mises à jour des déclarations prospectives, que ce soit à
la suite de nouvelles informations, d’événements futurs ou de tout autre élément. D’autres facteurs
susceptibles d’entraîner une différence notable entre les résultats réels et les résultats décrits dans les
déclarations prospectives sont énoncés dans le rapport annuel 2013 de Merck établi sur le formulaire
10-K et dans les autres documents déposés par la société auprès de la Securities and Exchange
Commission (SEC) des États-Unis et accessibles sur le site Internet de cette dernière (www.sec.gov).
# # #
1. Medline Plus. Melanoma. (Mise à jour en mai 2014). [En ligne] http://www.nlm.nih.gov/medlineplus/ency/article/000850.htm.
Consulté en novembre 2014.
2. Comité consultatif de la Société canadienne du cancer : Statistiques canadiennes sur le cancer. Statistiques canadiennes
sur le cancer, 2014. Toronto, Ontario, Société canadienne du cancer; 2014. [En ligne]
http://www.cancer.ca/~/media/cancer.ca/CW/cancer%20information/cancer%20101/Canadian%20cancer%20statistics/Canadi
an-Cancer-Statistics-2014-FR.pdf.
1
/
5
100%