1S Activité 6 Les classes d` alcool et passage d`un groupe

1
AGIR CH20 OXYDATION DES COMPOSES ORGANIQUE
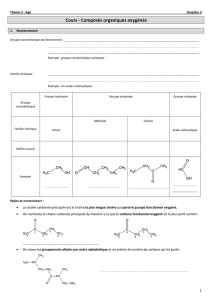
I LES CLASSES D’ALCOOLS
Les alcools sont regroupés en trois catégories, appelées classes, en fonction du nombre d’atomes de carbones liés
au carbone fonctionnel.
1) Alcool primaire
Un alcool est dit primaire lorsque le carbone porteur du groupement
-OH n’est lié qu’à un seul atome de carbone. (les autres liaisons portent des hydrogènes)
Donner la formule générale des alcools primaires en notant R le groupement comportant le
seul carbone lié au carbone fonctionnel.
2) Alcool secondaire
Un alcool est dit secondaire lorsque le carbone porteur du groupement -OH est lié à
deux atomes de carbone.
Donner la formule générale des alcools secondaires est (en notant R1 et R2 les radicaux por-
tant les deux carbones liés au carbone fonctionnel).
3) Alcool tertiaire
Un alcool est dit tertiaire lorsque le carbone porteur du groupement -OH est lié à trois
atomes de carbone.
Donner la formule générale des alcools tertiaires (en notant R1, R2 et R3 les radicaux portant
les trois carbones liés au carbone fonctionnel).
Donner les noms et la classe des alcools comportant 4 atomes de carbone.
II OXYDATION DES ALCOOLS
Les alcools peuvent donner lieu à des réactions d’oxydoréduction.
1) Oxydation par le dioxygène de l’air : la combustion
Exemple : Écrire l’équation de la combustion de l’éthanol dans le dioxygène de l’air :
.
Cette oxydation entraîne la destruction du squelette carboné.
Équation générale de la combustion d’un alcool dans le dioxygène de l’air :
Compléter avec les coefficients qui conviennent
C
n
H
2n+1
-OH + ………...O
2
à ……..CO
2
+ ………….H
2
O
Activité LES CLASSES D’ALCOOLS
ET PASSAGE D’UN GROUPE CARACTÉRISTIQUES A L’AUTRE

2
2) Oxydation ménagée : expérience de la lampe sans flamme
Expérience : Une spirale de cuivre est portée à incandescence et placée
au dessus d’une cuve d’éthanol tiédit.
Vidéo
Observations : la spirale………………………………………………..,
le papier pH indique ……………………………………
On sent une odeur fruitée caractéristique d’une aldéhyde
La 2,4-DNPH forme un précipité jaune avec le produit formé
le papier imbibé de réactif de Schiff devient rose.
Conclusion :
L’éthanol et le dioxygène de l’air réagissent à la surface du cuivre, le dioxygène oxyde l’éthanol.
La réaction est exothermique car elle maintient le fil de cuivre au rouge.
L’odeur est caractéristique de l’éthanal, l’acide formé est de l’acide éthanoïque ou acétique.
Équation : Oxydation de l’éthanol en éthanal :
Oxydation de l’éthanal en acide éthanoïque
Donc le bilan donne :
Une oxydation ménagée ne dégrade pas le squelette carboné.
Il n’y a pas de rupture de la liaison C-C.
Seul l’atome fonctionnel est modifié.
3) Oxydation ménagée des alcools en solution aqueuse
C’est une oxydation conservant le squelette carboné mais pas le groupe caractéristique hydroxyle. Les oxydants sont
souvent les ions permanganates ou les ions dichromates en solutions acides. L’oxydation ménagée conduit à des résultats
différents selon les classes d’alcools.
a) Oxydation d’un alcool primaire : le butan-1-ol par les ions permanganate :
On mélange du butan-1-ol avec du permanganate de potassium acidifié.
Il y a formation d’un aldéhyde : le butan-1-ol se transforme en butanal.
Écrire les couples concernés et les demi équations d’oxydo-réduction et l’équation bilan.
Équations : Couples ………………………………………………………….
…………………………………………………………………………………………………
……………………………………………………………………………………………………
________________________________________________________________________
……………………………………………………………………………………………………………………...
Spirale de cuivre
Éthanol tiédi
Papier pH

3
Conclusion : L’oxydation ménagée d’un alcool primaire conduit à la formation de l’aldéhyde ayant le même squelette
carboné.
Proposez un protocole pour prouver que le produit obtenu est bien un aldéhyde.
Remarque :
Si l’oxydant (permanganate de potassium) est en excès, il peut ensuite réagir avec l’aldéhyde formé et l’oxyder en aci-
de carboxylique.
Le bilan fait donc intervenir les couples ………………….. et ………………………………..;
Écrire les équations d’oxydo-réduction correspondantes
…………………………………………………………………………………………………
……………………………………………………………………………………………………
______________________________________________________________________________
………………………………………………………………………………………………………………………
Proposez un protocole pour prouver que le produit obtenu est bien un acide carboxylique
b) Oxydation d’un alcool secondaire : le butan-2-ol par les ions permanganate :
On mélange du butan-2-ol à du permanganate de potassium acidifié.
Il y a formation d’une cétone : le butanol se transforme en butanone.
Ecrire les couples concernés et les équations d’oxydo-réduction
Équations : Couples ………………………………………………………….
…………………………………………………………………………………………………
……………………………………………………………………………………………………
______________________________________________________________________________
………………………………………………………………………………………………………………………
Proposez une protocole opératoire pour prouver que le produit obtenu est bien la butanone.
c) Non oxydation d’un alcool tertiaire : le 2-methylpropan-2-ol par les ions permanganate :
La même expérience que les deux précédente montre qu’il n’y a pas de décoloration du permanganate.
Conclusion : L’oxydation ménagée d’un alcool primaire conduit à la formation d’un acide carboxylique, si l’oxydant
est en excès.
Conclusion : L’oxydation ménagée d’un alcool secondaire conduit à la formation de la cétone ayant le même
squelette carboné que l’oxydant soit en excès ou en défaut.
Conclusion : Un alcool tertiaire ne subit pas d’oxydation ménagée.

4
IDENTIFICATION DE QUELQUES GROUPES CARACTÉRISTIQUES
Aldéhyde
-
Formation d'un précipité jaune orangé avec la DNPH
-
Formation d'un précipité rouge brique avec la liqueur
de Fehling
-
Formation d'un miroir d'argent avec le réactif de Tol-
lens
Cétone
-
précipité orange à la DNPH
Acide carboxyli-
que
-
pH < 7
-
BBT Jaune
FONCTION OU
GROUPE CARACTÉ-
RISTIQUE
FORMULE TEST D’IDENTIFICATION
1
/
4
100%