Merck annonce les premiers résultats sur l`emploi du

Communiqué de presse
__________________________________________________________________________________
Relations avec les
médias :
Annick Robinson
Relations avec les
investisseurs :
Teri Loxam
438-837-2550
908-740-1986
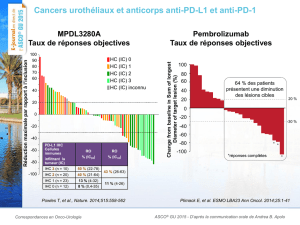
Merck annonce les premiers résultats sur l’emploi du pembrolizumab en
association avec d’autres immunothérapies issues de trois études de recherche
présentées lors du congrès international de la Society for Melanoma Research
De plus, les données de suivi à plus long terme sur l’utilisation du pembrolizumab comme
agent unique indiquent que ce produit continue à se révéler supérieur à l’ipilimumab en ce qui
a trait au taux de réponse globale et à la survie sans progression
KIRKLAND, Québec, le 21 novembre 2015 – Merck (NYSE : MRK), connue sous le nom de MSD à
l’extérieur du Canada et des États-Unis, a annoncé aujourd’hui les résultats de trois études évaluant
l’utilisation du pembrolizumab, le traitement anti-PD-1 de la société, en association avec trois autres
immunothérapies – epacadostat, talimogène laherparepvec (T-VEC) et ipilimumab – chez les patients
atteints d’un mélanome à un stade avancé. Ces résultats, qui ont été présentés aujourd’hui lors
d’exposés oraux distincts dans le cadre du congrès international 2015 de la Society for Melanoma
Research qui se tient à San Francisco, ont révélé une forte activité antitumorale et un profil d’innocuité,
ce qui concorde avec les données obtenues antérieurement avec le pembrolizumab pour les trois
traitements d’association étudiés.
« Nous avons démontré les bienfaits du pembrolizumab comme agent unique pour les cas
de mélanome avancé ou métastatique et nous cherchons maintenant d’autres associations pour les
patients atteints de cette maladie dévastatrice », a déclaré le Dr Roger Dansey, vice-président
principal et directeur du domaine thérapeutique, développement en oncologie au stade avancé,
Laboratoires de recherche de Merck. « Les données sur les associations présentées au congrès de
la Society for Melanoma Research, notamment l’association du pembrolizumab et de l’epacadostat,
peuvent nous rapprocher de notre objectif d’améliorer les résultats sans augmenter la toxicité de
façon considérable. »
En outre, les nouvelles données présentées à ce congrès et issues d’une étude de phase III
sur l’utilisation du pembrolizumab comme agent unique ont démontré que ce produit se révèle

- 2 -
supérieur à l’ipilimumab en ce qui concerne le taux de réponse globale et la survie sans progression
chez les patients n’ayant jamais été traités avec l’ipilimumab. Ces récentes données indiquent
également une survie sans progression supérieure chez deux fois plus de patients dans le groupe
recevant le pembrolizumab que dans le groupe recevant l’ipilimumab. Comme on l’a déjà précisé,
l’étude a permis de confirmer le paramètre de la survie globale. Les résultats rapportés par les
patients dans le cadre de cette même étude ont également été présentés.
À ce jour, le programme de développement clinique du pembrolizumab comporte la
participation de patients présentant plus de 30 types de tumeurs dans plus de 160 études cliniques,
dont plus de 80 portent sur l’association du pembrolizumab à d’autres traitements contre le cancer.
Résultats préliminaires issus de l’étude KEYNOTE-037 (pembrolizumab + epacadostat)
L’étude KEYNOTE-037, en cours, est une étude de phase I/phase II évaluant l’efficacité du
pembrolizumab en association avec l’epacadostat (INCB024360) – un inhibiteur sélectif de l’IDO1
expérimental – chez les patients atteints d’une forme avancée de cancer. Merck et Incyte Corporation
collaborent à cette étude. Les données de cette étude, recueillies dans la cohorte de patients atteints d’un
mélanome, ont été présentées le 21 novembre à 14 h 50 (HNP) par le Dr Omid Hamid, directeur, Melanoma
Center, The Angeles Clinic and Research Institute. Ces données ont été présentées plutôt ce mois-ci au
congrès annuel de la Society for Immunotherapy of Cancer dans le cadre d’une présentation sur plusieurs
types de tumeurs. Les données présentées comprenaient des données supplémentaires sur l’innocuité.
Les données préliminaires de cette étude ont révélé que chez 19 patients atteints d’un mélanome à
un stade avancé, l’association du pembrolizumab (deux doses étudiées – 2 mg/kg ou 200 mg toutes les trois
semaines) avec l’epacadostat (quatre doses étudiées – 25, 50, 100 ou 300 mg deux fois par jour), a entraîné
un taux de réponse globale de 53 % (n = 10/19), y compris trois réponses complètes et sept réponses
partielles. Le taux de maîtrise de la maladie était de 74 % (n = 14/19).
Les effets indésirables liés au traitement étaient conformes aux données déjà rapportées sur
l’innocuité du pembrolizumab comme agent unique. Au total, 15 % (n = 9/60) des patients inclus dans
l’évaluation de l’innocuité et atteints de divers types de tumeurs ont présenté des effets indésirables liés au
traitement de grade 3, selon l’évaluation faite par les chercheurs, notamment une éruption cutanée (8 %),
l’arthralgie (2 %), une augmentation du taux d’ASAT (2 %), une inflammation de la muqueuse (2 %) et des
troubles du système nerveux (2 %). Trois patients ont abandonné le traitement (un cas d’arthralgie de
grade 3, un cas d’augmentation du taux d’ASAT de grade 3, et un cas de troubles du système nerveux de
grade 2). On n’a observé aucun effet indésirable de grade 4 ni aucun décès lié au traitement.
Tel qu’il a déjà été annoncé, compte tenu de ces résultats, ce traitement d’association fera l’objet
d’une étude de phase III.

- 3 -
Résultats préliminaires issus de l’étude MASTERKEY-265 (pembrolizumab + T-VEC)
L’étude MASTERKEY-265, en cours, est une étude de phase 1b visant à évaluer l’innocuité,
l’efficacité et le profil de tolérance du pembrolizumab en association avec le talimogène laherparepvec
(T-VEC) – une immunothérapie oncolytique à base du virus de l’herpès simplex de type 1 (HSV-1) –
chez les patients présentant un mélanome à un stade avancé, non résécable, n’ayant jamais été traités.
Merck et Amgen collaborent à cette étude. Les données de cette étude ont été présentées le 21 novembre à
15 h 20 (HNP), par la Dre Georgina Long, professeure agrégée, Melanoma Institute Australia, université de
Sydney.
Les données présentées ont été recueillies auprès de 16 patients évaluables et étaient issues de la
première analyse de l’étude; les résultats ont démontré que le traitement associant le pembrolizumab
(200 mg toutes les deux semaines) et T-VEC (jusqu’à 4 mL de 106 UFP/mL, puis 108 UFP/mL toutes les
deux semaines) a entraîné un taux de réponse globale non confirmé de 56,3 % (n = 9/16) (IC à 95 % : 19,8
à 70,1) y compris deux réponses complètes et sept réponses partielles. Le taux de maîtrise de la maladie
était de 68,8 % (n=11/16) (IC à 95 % : 11 à 58,7).
Les effets indésirables liés au traitement étaient conformes aux données déjà rapportées sur
l’innocuité du pembrolizumab. Les 21 patients inscrits ont présenté au moins un effet indésirable, dont la
plupart étaient de grades 1 et 2. Les effets indésirables de tout grade les plus fréquemment observés
(survenus chez au moins 30 % des patients) étaient les suivants : fatigue (52 %), pyrexie (48 %), frissons
(43 %), éruption cutanée (38 %), céphalées (33 %) et nausées (33 %). Les effets indésirables de grade 3
incluaient les suivants : céphalées (5 %) et diarrhée (5 %). Les effets indésirables de grade 3 liés au
traitement survenus chez 5 patients incluaient l’anémie, l’hyperglycémie, l’hypoglycémie,
l’hypophosphatémie, une céphalée, une éruption maculaire et une éruption généralisée. Aucune toxicité
limitant la posologie n’a été rapportée.
À la lumière de ces résultats, nous prévoyons procéder à une phase III dans le cadre de cette étude.
Résultats préliminaires issus de l’étude KEYNOTE-029 (pembrolizumab + ipilimumab)
L’étude KEYNOTE-029, en cours, est une étude de phase I/phase II visant à évaluer l’innocuité,
l’efficacité et le profil de tolérance du pembrolizumab en association avec une faible dose d’ipilimumab chez
les patients présentant un mélanome à un stade avancé afin de déterminer si des doses plus faibles
d’ipilimumab pourraient améliorer le profil de tolérance du traitement d’association. Les résultats
préliminaires de cette étude ont été présentés le 21 novembre à 14 h (HNP), par la Dre Georgina Long,
professeure agrégée, Melanoma Institute Australia, université de Sydney.

- 4 -
Les résultats préliminaires obtenus auprès de 72 patients évaluables présentant un mélanome à un
stade avancé ont démontré que l’utilisation du pembrolizumab (2 mg/kg toutes les trois semaines) en
association avec une faible dose d’ipilimumab (1 mg/kg toutes les trois semaines, pour un total de quatre
doses) a permis d’atteindre un taux de réponse globale de 56 % (IC à 95 % : 43 à 67), y compris trois
réponses complètes et 37 réponses partielles. Le taux de maîtrise de la maladie était de 79 % (IC à 95 % :
68 à 88).
Des effets indésirables liés au traitement ont été observés chez 93 % (n = 67/72) des patients. Des
effets indésirables liés au traitement de grades 3 et 4 ont été observés chez 36 % des patients (n = 26/72), y
compris une élévation du taux de lipase (8 %), une élévation du taux d’amylase (6 %), une élévation du taux
d’ALAT (6 %), une élévation du taux d’ASAT (4 %), une éruption cutanée (3 %) et la diarrhée (1 %). Les
effets indésirables liés au traitement de grades 3 et 4 incluaient la thyroïdite, l’hypophysite, le diabète de
type 1, la pneumonite, la colite, l’hépatite, la pancréatite, des réactions cutanées graves et des événements
rénaux. On n’a observé aucun décès lié au traitement.
Autres résultats de l’étude KEYNOTE-006
L’étude KEYNOTE-006 est une étude pivot internationale de phase III, avec répartition aléatoire,
menée au su auprès de patients atteints d’un mélanome non résécable de stade III ou IV (stades avancés)
qui n’avaient jamais été traités avec l’ipilimumab et qui avaient reçu un traitement à action générale tout au
plus. Les patients ont reçu du pembrolizumab à raison de 10 mg/kg toutes les deux semaines (n = 279), du
pembrolizumab à raison de 10 mg/kg toutes les trois semaines (n = 277) ou quatre cycles de traitement avec
l’ipilimumab à raison de 3 mg/kg toutes les trois semaines (n = 278). Les résultats d’aujourd’hui fournissent
des données sur les autres paramètres, soit le taux de survie globale et la survie sans progression, d’après
un suivi additionnel de 6 mois (durée médiane du suivi : 13,8 mois). Il s’agit également de la première
présentation des résultats rapportés par les patients. Les résultats ont été présentés en deux séances
d’affiches par le Dr Jacob Schachter, Ella Lemelbaum Institute for melanoma, Sheba Medical Center, et la
Dre Teresa Petrella, Sunnybrook Health Sciences Centre, Université de Toronto.
Les résultats ont démontré que les taux de survie sans progression obtenus avec le
pembrolizumab après 12 mois étaient deux fois plus élevés que ceux obtenus avec l’ipilimumab –
37,7 % dans la cohorte de patients recevant le pembrolizumab toutes les deux semaines et de
36,3 % dans le groupe recevant le pembrolizumab tous les trois semaines, comparativement à
17,2 % dans le groupe recevant l’ipilimumab (risque relatif : 0,60 [IC à 95 % : 0,49 à 0,74;
p < 0,00001] et risque relatif : 0,59 [IC à 95 % : 0,48 à 0,73], respectivement). De plus, le taux de
réponse globale était de 36,2 % et 36,1 % chez les patients recevant le pembrolizumab aux
deux semaines ou aux trois semaines ([IC à 95 % : 30,6 à 42,1]; et [IC à 95 % : 30,4 à 42,1],

- 5 -
respectivement), comparativement à 12,9 % pour l’ipilimumab (IC à 95 % : 9,2 à 17,5).
Aucun cas de décès lié au traitement n’a encore été signalé dans le groupe pembrolizumab et on n’a
noté aucun décès lié au traitement dans le groupe ipilimumab, sauf celui rapporté antérieurement. On a
signalé moins d’effets indésirables liés au traitement de grades 3 à 5 dans le groupe recevant le
pembrolizumab que dans le groupe recevant l’ipilimumab – 15,1 % et 12,6 % des patients recevant le
pembrolizumab toutes les deux semaines et toutes les trois semaines ont présenté des effets indésirables
de grades 3 et 4, respectivement, comparativement à 19,9 % de ceux recevant l’ipilimumab. Les effets
indésirables à médiation immunitaire liés au traitement étaient conformes aux données déjà rapportées sur
l’innocuité du pembrolizumab et incluaient l’hypothyroïdie, l’hyperthyroïdie, la colite, l’hépatite, l’hypophysite,
la pneumonite, le diabète de type 1, l’uvéite, la myosite et la néphrite.
Par ailleurs, lors du congrès de la Society for Melanoma Research, on a aussi présenté, toujours en
rapport avec cette étude, une analyse prédéterminée de nouveaux résultats signalés par les patients en ce
qui concerne leur qualité de vie liée à la santé (QVLS) pour certains aspects, comme leur fonction physique,
émotionnelle, cognitive et sociale, selon l’EORTC (European Organization for Research and Treatment of
Cancer [EORTC] Core Quality of Life Questionnaire). L’étude a démontré que la QVLS était maintenue à un
degré plus élevé avec le pembrolizumab qu’avec l’ipilimumab – la variation par rapport aux valeurs initiales à
la semaine 12 (différence entre les traitements, selon la méthode des moindres carrés) pour le
pembrolizumab était de -2,3 (IC à 95 % : -5,21 à 0,62) pour le groupe recevant le produit toutes les deux
semaines et de -2,6 (IC à 95 % : -5,44 à 0,23) pour le groupe recevant le produit toutes les trois semaines,
respectivement, comparativement à -9,9 (IC à 95 % : -13,01 à -6,72) pour le groupe recevant l’ipilimumab.
En outre, le pembrolizumab a été associé à un meilleur profil de symptômes. Les patients des
groupes recevant le pembrolizumab affichaient une augmentation moins importante par rapport aux valeurs
initiales pour ce qui est des symptômes suivants : fatigue, douleur, dyspnée, perte d’appétit et diarrhée, ce
qui indique que même si ces symptômes se sont aggravés avec la prise du pembrolizumab, cette
exacerbation a été de moindre importance qu’avec l’ipilimumab. Le pembrolizumab a également permis de
réduire les nausées, les vomissements et insomnie, par rapport au début de l’étude, alors que ces
symptômes se sont aggravés avec la prise d’ipilimumab.
À propos du mélanome
Le mélanome, la forme la plus grave de cancer de la peau1, se caractérise par la croissance
incontrôlée des cellules qui produisent le pigment de la peau. L’incidence du mélanome a augmenté
au cours des quatre dernières décennies : environ 232 130 nouveaux cas ont été diagnostiqués dans
le monde entier en 2012.
 6
6
 7
7
 8
8
1
/
8
100%