Correction_CC_2010

UE CHI242
CORRECTION DU CONTROLE CONTINUE DE CHIMIE ORGANIQUE
Mardi 23 mars 2010
Exercice 1 :
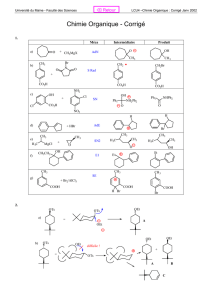
La structure de Lewis de l'alloisoleucine, acide aminé naturel, est la suivante:
HO
2
C C C C
2
H
5
H H
NH
2
CH
3
1 2 3
a- En respectant la numérotation des carbones ci-dessus et en utilisant la
représentation de Newman suivante, donner la configuration des carbones stéréogènes
présents dans cette molécule. (1 point(0,5 par configuration))
CO
2
H
H
2
N H
C
2
H
5
CH
3
H
Configuration de l'alloisoleucine : C2 : S et C3 : S
b- Dessiner en représentation de Fischer les quatre stéréoisomères de ce composé et
préciser leur configuration. (3 points (0,5 par dessin et 0, 25 par configuration))
Stéréoisomère 1 Stéréoisomère 2 Stéréoisomère 3 Stéréoisomère 4
CO
2
H
H NH
2
C
2
H
5
H CH
3
CO
2
H
H NH
2
C
2
H
5
H
3
C H
CO
2
H
H
2
N H
C
2
H
5
H CH
3
CO
2
H
H
2
N H
C
2
H
5
H
3
C H
Configuration :
C2 : R et C3 : R Configuration :
C2 : R et C3 : S Configuration :
C2 : S et C3 : R Configuration :
C2 : S et C3 : S
Exercice 2 :
On envisage la réaction de substitution nucléophile d’un chlore par un ion hydroxyde
sur les quatre chloroalcanes suivants :
Réaction 1 :
CH
3
Cl + HO
-
CH
3
OH + Cl
-
Réaction 2 :
+ HO
-
+ Cl
-
C
H
3
CCH
3
Cl C
H
3
CCH
3
OH
CH
3
CH
3
Réaction 3 :
+ HO
-
+ Cl
-
C
F
3
CCF
3
Cl C
F
3
CCF
3
OH
HH

Réaction 4 :
+ HO
-
+ Cl
-
C
HCl C
HOH
HH
a- Donner la structure des carbocations susceptibles d’être formés au cours de ces
quatre réactions et indiquer les effets électroniques que subissent ces intermédiaires (écrire
toutes les formes limites des carbocations subissant des effets mésomères) :
Structure et effets
électroniques
Carbocation 1
Structure et effets
électroniques
Carbocation 2
Structure et effets
électroniques
Carbocation 3
Structure et effets électroniques
Carbocation 4
C
H
H
H
Aucun effet
électronique
1 point
C
CH
3
CH
3
H
3
C
3 effets inductifs
donneurs
1 point
C
H
CF
3
F
3
C
2 effets inductifs
attracteurs
1 point
CH
2
CH
2
CH
2
CH
2
++
Effet mésomère qui réparti la
charge sur un grand nombre
d’atomes.
1,5 point
b- Classer les quatre carbocations par ordre de stabilité croissante : 0,5 point
2<1<3≅4
c- Deux de ces réactions se font suivant un mécanisme SN1 et les deux autres suivant
un mécanisme SN2. En justifiant votre réponse indiquer le mécanisme impliqué dans chacune
des réactions. 1 point (0,25 point par réaction)
Réaction 1 Réaction 2 Réaction 3 Réaction 4
Mécanisme : SN2 Mécanisme : SN1 Mécanisme : SN2
Mécanisme : SN1
Justification
Le carbocation
intermédiaire n’est
pas suffisamment
stable pour se former
Le carbocation est
stabilisé donc se
formera.
Justification :
Le carbocation
intermédiaire n’est
pas suffisamment
stable pour se former
Justification :
Justification :
Le carbocation est
stabilisé donc se
formera.
Exercice 3 :

Lors de la protonation d’un amide, l’attaque de H
+
peut s’imaginer sur l’azote ou sur
l’oxygène.
a- Ecrire les réactions envisagées sur CH
3
CONH
2
:
Réaction de protonation sur l’azote :
H
3
CCO
NH
2
+H
+
H
3
CCO
NH
3
0,5 point
Réaction de protonation sur l’oxygène :
H
3
CCO
NH
2
+H
+
H
3
CCO
NH
2
H
0,5 point
b-
La protonation se fait toujours sur l’oxygène et jamais sur l’azote. Justifier
cette observation Ecrire les réactions envisagées sur CH
3
CONH
2
:
La mésomérie dans l’amide de départ montre que la densité électronique sur l’oxygène est
supérieure à celle de l’azote :
H
3
CCNH
2
O
RCNH
2
O
1 point
D’autre part, l’acide conjugué résultant de la protonation sur l’oxygène est stabilisé par
mésomérie contrairement à celui résultant d’une protonnation sur l’azote.
RCNH
2
O
H
RCNH
2
O
H
1 point
Exercice 4
:
Soit le composé de formule brute C
6
H
12
O
2
:
1
- Quel est l’indice d’insaturation correspondant à la formule brute de ce composé ?

II = 1
0,5 point
2
- Quelles sont les fonctions susceptibles d’être présentes dans cette molécule ?
Acide ou ester sont les plus probables.
0,5 point
3
- Interpréter ses spectres IR, RMN
1
H et RMN
13
C et donner sa formule semi développée :
a) Spectre Infra rouge :
1 point b) Spectre RMN du proton :
Intégrale
:
0,5 point Déplacements chimiques : 1 point couplage : 1 point
Interprétation du spectre RMN
1
H :
c) Spectre RMN du carbone :
Interprétation du spectre de RMN
13
C :
Couplage : 1 point Déplacements chimiques : 0,5 point
Formule : 1 point
3000 2000
cm
-
1
1500 1000
500
25
50
75
100
125
150
175
S
D Q Q
T
ppm
0.50
1.00
1.50
2.00
2.50
3.00
3.50
4.00
4.50
5.00
5.50
I=6
I=3
I=2
I=1

H
3
C
H
2
CCO
O
CH CH
3
CH
3
1
/
5
100%