THM et cancer du sein : une nouvelle étoile est née – HRT and

10 | La Lettre du Gynécologue • n° 348-349 - janvier-février 2010
Le poids et la gynécologie
DOSSIER
THM, insuline et cancer du sein :
une nouvelle étoile est née
HRT and breast cancer: a new star is born
Christian Jamin*
* Association francophone de l’après-
cancer du sein (AFACS), 169, bd
Haussmann, 75008 Paris.
THM et cancer du sein :
généralités
Jusqu’en 1997, environ 60 études ont été produites sur
l’association potentielle entre traitement hormonal
de la ménopause (THM) et cancer du sein. Les résul-
tats de ces études étaient tellement discordants qu’il
était impossible de se faire une opinion. Ce qui les
différencie des études suivantes est qu’elles portaient
sur des populations en postménopause immédiate
et que la majorité des traitements ne comportaient
que des estrogènes. La méta-analyse du Lancet, en
les compilant, a retrouvé un risque relatif (RR) de
1,26, ce qui était trop faible pour affirmer la réalité
du risque du fait des innombrables biais, en parti-
culier d’inclusion et de surveillance inhérents à ces
études d’observation. L’étude WHI a levé le doute sur
l’augmentation du risque de cancer du sein au-delà
de 5 ans d’utilisation. Il faut noter que le risque est
augmenté uniquement chez les femmes traitées
par THM avant l’étude. Dans le groupe non anté-
rieurement traité, le risque n’est pas modifié : 1,06
(NS). Cela rend de ce fait impossible l’évaluation de
la durée nécessaire de THM avant que n’apparaisse
une augmentation significative du risque. Même si
cette étude est ce que nous avons et – probablement
– aurons de mieux, elle ne permet cependant pas,
avec son RR de 1,26 (0,83-1,92), de lever toutes les
incertitudes tant est faible cette augmentation non
significative : +0,08 cas par an pour 100 femmes trai-
tées. Elle concorde cependant avec la méta-analyse
du Lancet et avec la quasi-totalité des autres études
publiées depuis. Mais les mêmes biais ne sont-ils pas
susceptibles de reproduire les mêmes résultats ? Il
n’y a pas, à ce jour, de raison indiscutable de penser
que le risque est différent selon l’estrogène utilisé et
sa voie d’administration.
Les rares études ayant évalué l’effet de la dose d’es-
trogènes n’ont pas mis en évidence d’effet-dose.
Ainsi, la recommandation demandant d’utiliser
les doses minimales efficaces n’a pas de niveau de
preuve supérieure au simple bon sens.
Pour le poids, seules les femmes ayant un indice de
masse corporelle (IMC) inférieur à 25 kg/m² voient
leur risque augmenter. Les femmes plus fortes
après la ménopause ont un surrisque qui n’est pas
modifié par le THM. Cela permet une réflexion de
la plus haute importance et pourtant bien souvent
ignorée : l’augmentation du risque observée, dans
les études WHI en particulier, n’est applicable qu’aux
populations étudiées et non aux sous-populations à
risque comme les femmes fortes ou celles ayant des
antécédents familiaux de cancer du sein. Une étude
ancienne a d’ailleurs montré que le THM n’augmen-
tait pas le risque déjà élevé chez les femmes avec
antécédents familiaux de cancer du sein ou chez
celles ayant des mastopathies à risque proliférantes.
Globalement, le RR est faible mais, il semble qu’il
augmente sur de longues durées de traitement (10
ou 15 ans), induisant de ce fait un risque attribuable
élevé d’autant que le risque spontané augmente
avec l’âge. Le RR, faut-il le rappeler, est le facteur
multiplicatif du risque spontané induit par le
traitement. Un RR induira donc d’autant plus de
nouveaux cas (risque attribuable) que le risque spon-
tané est élevé. Cependant, on manque de données
sur l’influence des traitements sur de très longues
durées. En effet, s’il s’agit d’un risque de promo-
tion, il serait logique de constater une diminution
après un certain temps, du fait que tous les cancers
présents auront été révélés. Cette diminution avec
de très longues durées, possible d’après certains
travaux, est cependant loin d’être prouvée. Dans
l’étude WHI, les femmes recevant le placebo ont un
risque de cancer du sein plus faible lorsqu’elles ont
pris un THM avant l’étude, comparées aux femmes
sous placebo dans l’étude non traitées antérieure-
ment (calcul personnel). La rapidité d’apparition

La Lettre du Gynécologue • n° 348-349 - janvier-février 2010 | 11
Résumé
du surrisque, le fait que cette augmentation du
risque disparaît rapidement à l’arrêt du traitement
et l’absence d’augmentation des cancers in situ rend
très probable le fait qu’il s’agit d’un phénomène de
promotion (stimulation de cancers infracliniques
présents), de cancers existants et non d’initiation
(création de cancers de novo). Ainsi, comme le risque
spontané de cancer du sein augmente avec l’âge, la
révélation de ces cancers par stimulation exogène
augmente elle aussi logiquement avec l’âge.
Le bras estrogènes seuls de l’étude WHI et de
nombreuses autres études de cohorte ne montrent
pas d’augmentation avec les estrogènes seuls (RR :
0,77 ; 0,57-1,06). Seule une étude de très long suivi
(plus de 15 ans) évoque une augmentation très
tardive du risque sous estrogènes seuls.
L’étude française de cohorte E3N ne met pas en
évidence d’augmentation du risque sous l’association
estrogènes + progestérone naturelle ou rétroproges-
térone. Pour la rétroprogestérone, une autre étude
épidémiologique, finlandaise cette fois, ne met pas
en évidence d’augmentation du risque de cancer du
sein. En revanche, l’étude E3N trouve une élévation
du risque sous estrogènes seuls après 5 ans de trai-
tement (effet dépistage ?) et lors de l’association
estrogènes + progestatifs de synthèses, quels qu’ils
soient (RR : 1,7 [significatif]).
Tous ces résultats sont en harmonie avec la mesure
du rapport apoptose/prolifération, qui montre une
promotion maximale avec l’association estrogènes +
médroxyprogestérone acétate (MPA) ou NETA (ce
qui concorde avec l’étude MWS, dite du Million),
intermédiaire avec les estrogènes seuls, et mini-
male avec l’association estrogènes + progestérone et
rétroprogestérone ou la tibolone. Pour cette dernière,
une étude randomisée versus placebo ne met pas
en évidence d’augmentation du risque de cancer du
sein après 3 ans de traitement, faisant même ressortir
une diminution significative du risque.
L’influence des traitements sur la mortalité par
cancer du sein fait, aujourd’hui encore, l’objet de
débats. Il est admis, malgré les récents résultats
de l’étude WHI, que les cancers découverts seraient
de meilleur pronostic, de forme histologique mieux
différenciée (quasi uniquement des cancers lobu-
laires ou lobulocanalaires) comportant davantage
de formes hormonosensibles (E3N). De plus, le
risque métastatique évalué sur 20 ans est plus faible
qu’avec les cancers “sauvages”, quel que soit le site
considéré. Ces caractéristiques de bon pronostic
ne s’observent pas chez les femmes traitées par
estrogènes seuls et par l’association estrogènes +
progestérone, précisément lorsque les traitements
ne seraient pas promoteurs.
Enfin, concernant l’utilisation de THM après un
cancer du sein, nous disposons de trois études de
niveau 1 (randomisées versus placebo en double
aveugle) : deux d’entre elles montrent une augmen-
tation des récidives, l’une avec l’association estro-
gènes + MPA (étude Habits), l’autre sous tibolone
(étude Liberate) ; la troisième (étude Stockholm),
majoritairement sous estrogènes seuls, ne met pas
en évidence d’augmentation des récidives.
Un nouvel acteur de poids :
l’insuline
Le fait que le cancer du sein touche principale-
ment les femmes après la puberté et le fait que
l’on ait assisté à des régressions de cancer après
ovariectomie ont incité à juste titre à attribuer aux
stéroïdes sexuels une part prépondérante dans la
genèse et dans la promotion du cancer du sein. Pour
nombre de chercheurs, cette part prépondérante
s’est transformée en part unique, les amenant à
traquer l’estrogène comme bouc émissaire de toutes
les observations épidémiologiques et cliniques.
Quelques faits gênants, comme la poursuite de
l’augmentation de l’incidence du cancer du sein
après la ménopause, ne pouvaient cependant
pas trouver leur explication dans cette approche
simpliste. N’en déplaise aux monomaniaques du
“tout-estrogènes”, un nouvel acteur a toutes les
chances de prendre une place prépondérante : il
s’agit de l’insuline.
Dans l’étude observationnelle WHI, un bilan biolo-
gique hormonal exhaustif a été pratiqué à l’entrée
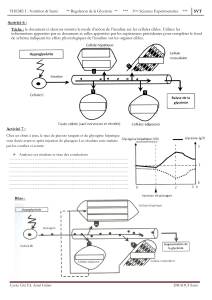
Sous traitement hormonal de la ménopause (THM) et après une durée d’administration encore mal définie, on observe une
augmentation des diagnostics de cancer du sein avec un risque relatif d’environ 1,3. Cela ne s’observe que chez les femmes
minces et les cancers du sein ainsi révélés sont ER+, lobulaires et de meilleur pronostic. Cependant, nombre d’observa-
tions épidémiologiques ne s’expliquent pas par le seul effet des estroprogestratifs. Des travaux de plus en plus nombreux
évoquent un effet synergique de l’estradiol et de l’hyperinsulinisme. L’insuline, facteur de risque démontré aussi important
que l’estradiol, joue un rôle dans de nombreuses observations cliniques et épidémiologiques comme l’augmentation du
risque chez les femmes obèses après la ménopause, sa diminution par l’exercice physique, son maintien en postménopause
malgré la baisse de l’estradiol, l’augmentation du risque chez les diabétiques de type 2 avec sa diminution probable sous
biguanides, son augmentation sous sulfamides hypoglycémiantes et insulinothérapie, etc. Mais, encore plus intéressant
est de se reporter à l’influence des THM sur le risque de cancer du sein :
– l’apport d’estradiol seul n’augmente pas le risque de cancer du sein (étude WHI) ; rappelons que l’estradiol améliore
l’insulinosensibilité ;
– les progestatifs artificiels en association avec les estrogènes augmentent le risque alors que l’association avec la
progestérone ne le modifie pas (E3N).
Rappelons que l’étude PEPI nous a appris que les progestatifs artificiels augmentent l’insulinorésistance alors que ce
n’est pas le cas de la progestérone naturelle ! Ainsi les hormones stéroïdes sexuelles sont loin d’être seules en cause
dans la genèse et la promotion des cancers du sein.
Mots-clés
Cancer du sein
Estrogènes
Progestatifs
Progestérone
Insuline
Insulinorésistance
Traitement hormonal
de la ménopause
Keywords
Breast cancer
Estrogen
Progestogen
Progesterone
Insulin
Insulin-resistance
Hormonal replacement
therapy

12 | La Lettre du Gynécologue • n° 348-349 - janvier-février 2010
Le poids et la gynécologie
DOSSIER
dans l’étude ; les corrélations entre les niveaux de
départ de ces hormones et le risque subséquent de
cancer du sein a permis de mettre en évidence non
plus un mais deux acteurs fortement prédictifs du
risque : l’estradiol et l’insuline. À noter que dans ce
travail, ni l’IGF1 ni l’IGFBP3 ne sont des facteurs de
risque indépendants. L’effet de l’insuline n’est pas
affecté par l’ajustement du taux d’estradiolémie ; de
même, l’ajustement du taux d’insuline n’affecte pas
l’effet de l’estradiol. Il s’agit donc de deux facteurs
indépendants. Au total, à ce jour, quatre études
ont évalué le niveau d’insuline comme facteur de
risque prédictif de cancer du sein. Deux d’entre elles
ne trouvent pas de corrélation mais incluaient des
femmes sous THM, et une étude en plus de WHI
qui n’incluait pas de femmes sous THM retrouve le
même résultat que l’étude WHI observationnelle.
Un autre essai a montré que le taux d’insuline d’une
femme ménopausée atteinte d’un cancer du sein
mesuré le jour du diagnostic est fortement prédictif
de son risque de mortalité à 10 ans. Le résultat est
identique pour le C peptide et pour le rapport C
peptide/fructosamine.
Une autre étude retrouve, après stratification de
l’insulinémie en quartiles, que le quartile supérieur
d’insulinémie (versus quartile inférieur) donne
des RR de mortalité de 8 et de récidive de 4. Dans
l’étude MA14, l’insulinorésistance est associée à une
réduction de la survie sans récidive. Enfin, un travail
préliminaire montre que si l’on mesure les récepteurs
de l’insuline dans les tumeurs, les tumeurs les plus
riches en récepteurs sont de plus mauvais pronostic.
Sur le plan cellulaire, l’insuline stimule la prolifé-
ration des cellules mammaires normales et cancé-
reuses et elle a un effet de promotion des tumeurs
du sein. Chez l’animal, le récepteur de l’insuline est
surexprimé dans le cancer du sein et, chez la femme,
l’hyperinsulinisme est associé à une augmentation de
la production ovarienne d’estrogènes, à une diminu-
tion de la protéine porteuse de l’estradiol (SHBG), et
de ce fait, à une augmentation de l’estradiol libre. La
fixation de l’insuline à son récepteur sur les cellules
de cancer du sein augmente l’activité MAP-kinase
(k) et phosphatidylinositol-kynase. De plus, l’insuline
active la transcription du récepteur de l’estradiol
alpha dans les cellules cancéreuses, même en l’ab-
sence d’estradiol. Par ailleurs, l’estradiol active la voie
MAP-K de l’insuline. Enfin, dans les milieux de culture
de cellules de cancer du sein, l’estradiol n’exerce
son effet prolifératif qu’en présence de facteurs de
croissance, dont fait partie l’insuline.
Cela permet d’éclairer sous un autre jour nombre de
situations jusqu’à présent mal expliquées. La méno-
pause s’accompagne de l’apparition d’une insulino-
résistance, ce qui pourrait expliquer la persistance
de l’incidence des cancers du sein à la ménopause,
alors que l’arrêt des traitements hormonaux s’ac-
compagne d’une chute rapide de l’incidence des
cancers du sein.
Le surpoids est un facteur de risque reconnu de
cancer du sein après la ménopause, alors qu’il est
plutôt protecteur avant la ménopause. Rappelons
à ce propos que l’obésité gynoïde préménopausique
n’altère pas l’insulinosensibilité, alors que l’obésité
androïde postménopausique, elle, s’accompagne
d’une insulinorésistance.
Le syndrome métabolique multiplie par 2 le risque
de cancer du sein, et ce indépendamment du taux de
testostérone et de son marqueur clinique, le rapport
tour de taille/tour de hanche. De plus, ce rapport
est prédictif de la mortalité par cancer du sein lors
de la découverte du cancer. Le HDL-cholestérol est,
lui, inversement corrélé à l’insulinémie et au risque
de cancer du sein.
L’activité physique est aujourd’hui un facteur de
protection prouvé du cancer du sein, ainsi qu’un
facteur de diminution de la mortalité par cancer du
sein. Cette protection existe aussi chez les femmes
ayant une mutation BRCA 1/2. L’activité physique,
en augmentant la masse musculaire, améliore en
effet l’insulinosensibilité et diminue donc le taux
d’insuline circulant.
La consommation d’aliments riches en acides gras
trans est associée à un risque élevé de cancer du sein
(RR : 1,75 ; 1,08-2,83) dans l’étude E3N. Or, cette
consommation s’accompagne aussi d’un risque plus
élevé d’insulinorésistance et de diabète.
L’alcool, facteur de risque reconnu de cancer du sein
après la ménopause, diminue l’insulinosensibilité
et augmente les récepteurs de l’insuline dans les
tumeurs.
L’index glycémique des aliments est un marqueur
de la réponse insulinique à leur ingestion. Plus
un individu a un régime riche en aliments à index
glycémique élevé, plus son risque de cancer du sein
augmente.
Les diabétiques de type II non insulinodépendants
ont un hyperinsulinisme et un RR de cancer du sein
de 1,2. Des études ont montré que le traitement de
ces diabètes de type II par la metformine s’accompa-
gnait d’une diminution de la mortalité par cancer du
sein, alors qu’un traitement par sulfamides hypogly-
cémiants ou par insuline augmente cette mortalité.
Cette synergie estradiol/insuline éclaire les rapports
entre THM et risque de cancer du sein. Rappelons
que les estrogènes à dose moyenne par voie orale

La Lettre du Gynécologue • n° 348-349 - janvier-février 2010 | 13
DOSSIER
ou cutanée améliorent l’insulinosensibilité et donc
diminuent l’insulinémie, alors que les estrogènes
oraux à forte dose et/ou associés aux progestatifs
artificiels, en particulier le MPA, augmentent l’insu-
linorésistance. De plus, l’étude PEPI a montré que,
contrairement au MPA, la progestérone naturelle
n’altère pas l’insulinosensibilité améliorée par les
estrogènes conjugués équins. Ainsi, ce serait par
l’intermédiaire de l’insuline que les THM estroproges-
tatifs artificiels augmenteraient le risque de cancer
du sein, que les estrogènes seuls diminueraient ce
risque et que, contrairement aux progestatifs, la
progestérone n’aurait pas d’effet délétère.
De plus, les effets délétères du THM contenant des
progestatifs artificiels sont maximaux immédiate-
ment en postménopause lorsque l’insulinorésis-
tance ne s’est pas installée, alors qu’à distance de
la ménopause, les mêmes traitements ont un effet
moins brutal du fait que l’insulinorésistance liée à
la ménopause a déjà eu un effet propre.
Autres hormones d’origine
adipocytaire et cancer du sein
Le tissu adipeux sécrète des hormones appelées
“adipokines”. Le volume du tissu adipeux est
augmenté par l’insuline, qui pourrait avoir un rôle
direct sur les cellules cancéreuses, mais aussi par
l’augmentation des sécrétions d’adipokines liée à
une masse grasse plus élevée. Parmi ces adipokines,
la résistine est plus élevée chez les femmes ayant
un cancer du sein ; elle est associée à la gravité du
cancer et est en partie responsable de l’élévation
de l’insulinémie dans l’insulinorésistance, elle-
même dépendante de la masse adipeuse. Une autre
adipokine, la leptine, est également élevée chez
les femmes ayant un cancer du sein, en particulier
métastatique ; de plus, la leptine augmente l’aro-
matase, donc la production intramammaire d’es-
trogènes. L’interleukine-1, elle aussi sécrétée par le
tissu adipeux, a un taux corrélé au risque de cancer
du sein et à sa progression. Enfin, l’adiponectine est
abaissée en cas de syndrome métabolique, de diabète
de type II et d’obésité androïde. Elle est basse chez
les femmes ayant un cancer du sein et son taux est
inversement associé à l’envahissement ganglionnaire.
Elle augmente l’apoptose des cellules cancéreuses
mammaires et diminue la néovascularisation.
Ainsi, le couple insuline/estrogènes a un effet syner-
gique et indépendant sur le risque de cancer du sein
et il semble que l’estradiol ne soit pas ou peu promo-
teur de ces cancers en l’absence d’hyperinsulinisme.
Le tissu adipeux insulinodépendant pourrait aussi
être l’un des organes effecteurs de cette synergie
par l’intermédiaire des adipokines. Cette nouvelle
approche, maillon manquant possible à la compré-
hension des rapports entre hormones stéroïdes et
cancer du sein, pourrait dans l’avenir être à l’origine
de nouvelles voies thérapeutiques et/ou préventives
du cancer du sein. ■
Une bibliographie exhaustive est disponible sur simple demande à :
aGENDa
4-5 mars 2010 – Deauville – 10es
Journées gynécologiques, pédia-
triques et obstétricales modernes.
Renseignements et inscriptions : JP
Com, 1, rue Isidore-Pierre, 14000
Caen. Tél. : 02 31 27 19 18. Fax : 02
31 27 19 17. Internet : www.jpcom.
fr
5 mars 2010 – Angers, Château
de la Perrière, Avrillé – 10es Jour-
nées angevines de gynécologie
obstétrique sur le thème : Le
praticien et l’expert : même
combat ! Renseignements et
inscriptions : Isabelle Girault,
secrétariat du Pr Ph. Descamps, service de gynéco-
logie obstétrique, CHU, 49933 Angers Cedex 09.
Tél. : 02 41 35 48 99. Fax : 02 41 35 55 32. isgirault@
chu-angers.fr
20-22 mai 2010 – Deauville – 7
e
Congrès
de la Société de chirurgie gynécologique et
pelvienne. Renseignements et inscription :
JP Com, 1, rue Isidore-Pierre, 14000 Caen.
Tél. : 02 31 27 19 18. Fax : 02 31 27 19 17.
Internet : www.jpcom.fr
4-5 juin 2010 – Hôtel Marriott, Paris
– 1er congrès du Groupe d’étude sur
la ménopause et le vieillissement
hormonal. Renseignements et inscrip-
tion : JP Com, 1, rue Isidore-Pierre,
14000 Caen. Tél. : 02 31 27 19 18. Fax :
02 31 27 19 17. Internet : www.jpcom.fr/www.gemvi.org
1
/
4
100%