thèse_MaiteBerdoula..

T
Th
hè
ès
se
e
d
de
e
D
Do
oc
ct
to
or
ra
at
t
Présenté à
L’Université de Pau et des Pays de l’Adour
P
Pa
ar
r
M
Ma
aï
ït
té
é
B
Be
er
rd
do
ou
ul
la
ay
y
Pour l’obtention du grade de
Docteur
Spécialité : Ecologie Microbienne
Analyses physico-chimiques et microbiologiques
de façades en pierre exposées aux embruns
marins du Golfe de Gascogne
S
So
ou
ut
te
en
nu
ue
e
p
pu
ub
bl
li
iq
qu
ue
em
me
en
nt
t
l
le
e
2
28
8
n
no
ov
ve
em
mb
br
re
e
2
20
00
08
8
Après avis de :
Marie Libert Commissariat à l'Energie Atomique (CEA) Rapporteur
Pr Yvan Moënne Loccoz Université de Lyon 1 Rapporteur
Devant la commission d’examen formée de :
Pr Henry Cardy Université de Pau et des Pays de l’Adour Co-directeur de thèse
Pr Michel Magot Université de Pau et des Pays de l’Adour
Pr Claude Mouches Université de Pau et des Pays de l’Adour
Dr Jean-Claude Salvado Université de Pau et des Pays de l’Adour Directeur de thèse
Jacques Tortos Nobatek
Dr Jesus Valero Inasmet – Tecnalia
IPREM


Remerciements
Remerciements
Au terme de ce doctorat, effectué à l’UFR Sciences et Techniques de la Côte Basque,
au sein de l’Equipe Environnement et Microbiologie de l’IPREM, j’adresse mes
remerciements au Pr Robert Duran pour m’avoir accueillie au sein de son laboratoire.
Je remercie également Jacques Tortos, Directeur du Centre de Ressource
Technologique Nobatek, pour avoir coordonné et financé la thèse sous CIFRE avec
l’Université de Pau et des Pays de l’Adour.
Je remercie le Conseil des Elus du Pays Basque, le Conseil Régional Aquitaine et le
Conseil Général des Pyrénées Atlantique pour avoir soutenu financièrement ce projet.
Je tiens à remercier Marie Libert et Yvan Moënne-Loccoz pour avoir accepté
d’évaluer mon travail. Je remercie également Michel Magot, Jesus Valero, Claude Mouches
et Jacques Tortos pour avoir bien voulu participer à mon Jury de thèse.
Mes remerciements vont également à Jean-Claude Salvado, directeur de thèse, et
Henry Cardy, co-directeur de thèse, pour m’avoir fait confiance et m’avoir guidée durant ces
trois années.
Je remercie également le maire de Biarritz et Mme Françoise Pautrizel, directrice du
Musée de la Mer, pour avoir autorisé l’exposition de pierres sur la terrasse du musée. Merci
également à Vincent Gaillet pour son accueil et son aide au Musée de la Mer.
Un grand merci à Jesus de la Fondation INASMET pour sa disponibilité et qui m’a
fait profiter à de nombreuses reprises de ses connaissances en microbiologie et sur la
biodétérioration de monuments.
Merci aux autres membres du comité de thèse, Benjamin et Oïana pour l’aide
apportée au cours de ma thèse.
Un grand merci aussi à Fanny, ma première stagiaire, qui m’a beaucoup aidée et qui
a fait grandement avancer mes travaux.

Remerciements
Je remercie Dominique pour la gestion administrative de la thèse. Merci à Henry et
Hélène pour les conseils scientifiques qu’ils m’ont fourni et qui m’ont beaucoup aidé au cours
de la thèse.
Mes remerciements vont également à tous les permanents du laboratoire, pour leurs
conseils et leur gentillesse : Rémy, Béatrice, Christine, Pierre, Cristiana, Régis, Jean-
Philippe, Régis, Solange, Pat, Marie-Jo, Christine et Claude. Merci également à toute
l’équipe de Nobatek.
Je pense avec plaisir aux bons moments passés à Montaury, je les dois aux
enseignants chercheurs, administratifs, techniciens, informaticiens et autres permanents qui
forment la « grande famille » de l’UFR.
Je n’oublie pas Elena, Sylvain, Nicolas, Gaël, Damien, Louis-Romain, Dung, Wen,
Raphaëlle, Auriane, Pierre-Jo, Guillaume, Benji, Sylvain, Sandrine, Ludo, Isa, Sabrina,
« les » Magali; Laurent, je vous souhaite à tous beaucoup de bonheur et de réussite, ainsi
qu’à Didi, Jean-Fa, Julien, Lulu, Carline, Nono, Yann et Jean-Marc, les biologistes de
Poitiers.
Un grand merci aux frérots, sœurettes, beaux-frérots et belles-sœurettes, ainsi que la
famille de Nicolas qui ont su me soutenir, me changer les idées et me remonter le moral
durant les moments durs.
Merci à papa et maman pour votre soutient constant et toute l’aide que vous avez pu
m’apporter malgré les dissensions.
Chouchou, merci d’avoir été là, d’avoir supporté mes sautes d’humeur et mes longs
bavardages au téléphone. Merci de tout cœur pour tes conseils, ton soutient et de m’avoir
toujours encouragée.
Spéciale dédicace à tous mes amis : Virginie, Lauriane, Sophie, Max, Maylis, Myriam,
Valéry, Fon, Marie, Sian, Chantal, Philippe, Jéjé et Cristelle, les « anciens » du cyber, et les
membres de la peña Campera, pour tous les bons moments passés avec eux.

Sommaire
I
Sommaire
INTRODUCTION GENERALE ......................................................................................................................... 1
I - ETUDE BIBLIOGRAPHIQUE ...................................................................................................................... 5
INTRODUCTION ................................................................................................................................................... 5
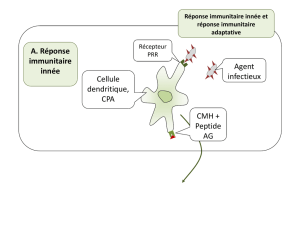
1-LA PIERRE ET LES MICROORGANISMES ....................................................................................................... 7
1.1-Facteurs influençant la colonisation de la pierre par les microorganismes ou bioréceptivité de la
pierre ......................................................................................................................................................... 8
1.1.1-Propriétés physico-chimiques des pierres ................................................................................................... 8
1.1.2-Facteurs environnementaux ........................................................................................................................ 9
1.2-Les colonisateurs de la pierre ....................................................................................................... 10
1.2.1-Les différents colonisateurs ...................................................................................................................... 11
1.2.2-Les méthodes d’adaptation des microorganismes à la pierre et son environnement ................................. 16
1.2.3-Conclusion ................................................................................................................................................ 18
2-ETUDE DE LA BIODIVERSITE..................................................................................................................... 20
2.1-Les méthodes microbiologiques et biochimiques .......................................................................... 21
2.2-Les techniques basées sur la biologie moléculaire ....................................................................... 22
2.3-La RFLP, méthode de biologie moléculaire .................................................................................. 26
2.3.1-Extraction de l’ADN de l’échantillon environnemental ............................................................................ 27
2.3.2-Amplification par PCR et choix des amorces ........................................................................................... 28
2.3.3-Clonage et identification phylogénétique.................................................................................................. 32
2.4-Conclusion..................................................................................................................................... 33
3-LES PROCESSUS DE BIODETERIORATION DE LA PIERRE ............................................................................. 36
3.1-Importance de l’eau ...................................................................................................................... 36
3.1.1-Action directe de l’eau .............................................................................................................................. 37
3.1.2-Action indirecte de l’eau ........................................................................................................................... 38
3.2-Détérioration de la pierre par les microorganismes ..................................................................... 41
3.2.1-Effets de la croissance des microorganismes sur la pierre ........................................................................ 41
3.2.2-Les effets de la pigmentation des microorganismes sur la pierre .............................................................. 42
3.2.3-L’action des exo-polysaccharides dans la biodétérioration de la pierre .................................................... 42
3.2.4-Sécrétions d’acides par les microorganismes et solubilisation de la pierre ............................................... 43
3.3-Le rôle des sels marins .................................................................................................................. 45
3.3.1-Processus chimiques de la détérioration de la pierre en présence des sels marins .................................... 45
3.3.2-L’environnement marin et la biodétérioration .......................................................................................... 46
3.4-Les méthodes d’étude de la biodétérioration de la pierre ............................................................. 48
3.5-Conclusion sur la biodétérioration de la pierre ............................................................................ 49
4-TRAITEMENTS ET PROTECTION DE LA PIERRE ........................................................................................... 53
4.1-Traitements curatifs....................................................................................................................... 53
4.2-Méthodes préventives .................................................................................................................... 53
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
 196
196
 197
197
 198
198
 199
199
 200
200
 201
201
 202
202
 203
203
 204
204
 205
205
 206
206
 207
207
 208
208
 209
209
 210
210
 211
211
 212
212
 213
213
 214
214
 215
215
 216
216
 217
217
 218
218
 219
219
 220
220
 221
221
 222
222
 223
223
 224
224
 225
225
 226
226
1
/
226
100%