A PROPOS DES BIOFILMS

A PROPOS DES BIOFILMS
Par Corinne BENOLIEL
Docteur en Pharmacie, Directrice de SCIENTIS
Un biofilm est une communauté de microorganismes structurée dans une matrice protectrice.
Cette entité peut s’installer en quelques heures. Grâce à cette coopération, les microorganismes
présentent une résistance accrue face aux agents biocides. Cette résistance, liée à la matrice
extracellulaire et à des modifications génotypiques et phénotypiques, peut être accentuée par
certaines conditions environnementales, telle que notamment la température.

De nombreux secteurs sont susceptibles d’être concernés (médical au niveau des cathéters, industriel,
agroalimentaire au niveau des différents circuits, agroalimentaire, …des biofilms peuvent même se
constituer au niveau du béton), avec pour conséquence notamment des infections nosocomiales ou
des toxi-infections alimentaires collectives (TIAC).
Des procédures d’hygiène générale sont mises en place dans les unités, des produits de détergence
et de désinfection sont utilisés. Ceux-ci revendiquent des activités bactéricide, levuricide et fongicide,
parfois virucide, voire sporicide, et même pour certains « anti-biofilms ».
Mais, quelle est l’efficacité réelle de ces produits et quelles sont leurs propriétés pour détruire les
biofilms ?
Partant du constat que nous travaillions sur des normes d’efficacité antimicrobienne en tube à essais
et/ou sur supports, nous permettant de tester des cellules microbiennes à l’état planctonique ou
adhérées, mais jamais structurées en biofilms, SCIENTIS en partenariat avec le laboratoire PROBIOGEM
de Lille, a lancé trois ans de recherche fondamentale sur la problématique des biofilms.
Les normes à notre disposition (standard français , européen, ISO) ne nous permettent pas de prouver
qu’un détergent/désinfectant a une efficacité sur ces structures pourtant majoritaires .
Nous nous sommes concentrés sur deux types de supports représentatifs de nombreuses installations
et équipements : l’acier inoxydable et le polycarbonate. Ceux-ci présentent des propriétés de surface
différentes. Le premier étant hydrophile et chargé négativement tandis que le second est hydrophobe
et neutre. Les microorganismes structurés en biofilm excrètent des substances leur permettant
d’adhérer de façon importante au niveau des coudes des canalisations, des buses de remplissage …

Nous avons donc étudié les propriétés de ces surfaces, ainsi que l’adhésion des microorganismes sur
celles-ci, à l’aide de techniques analytiques et microscopiques avancées. L’objectif était de déterminer
la bonne mouillabilité d’un produit sur la surface à traiter et de vérifier si des microorganismes
pouvaient adhérer à des supports définis, et ainsi potentiellement générer des biofilms ». L’efficacité
de détergents-désinfectants a été testée aux concentrations d’emploi revendiqué par les fabricants,
ainsi que l’influence de la température sur la constitution des microorganismes en biofilms et celle liée
à la rugosité des surfaces.
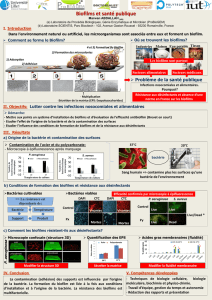
Une méthodologie a été mise au point pour vérifier l’activité des produits revendiquant un effet anti-
biofilm, ainsi qu’un module adapté à la création de ces biofilms, à ce jour mono-bactériens (i.e.
composés d’un seul type de bactérie pour chaque biofilm).
Les bactéries ciblées furent Pseudomonas aeruginosa (bacille pyocyanique) et Staphylococcus aureus
(staphylocoque doré).
Il est ainsi possible de déterminer si le produit, à la concentration revendiquée, va, en un temps de
contact défini, éliminer une charge significative de microorganismes structurés en biofilm, la viabilité
de ceux-ci étant évaluée in fine par des techniques de marquage cellulaire et de visualisation par
microscopie à épifluorescence, afin de savoir s’ils sont bien détruits ou capable de se revivifier.
L’étude consiste en effet à développer un biofilm avec un type de bactérie et sur un support prédéfini,
puis à mettre en contact ce biofilm avec le produit à tester. Enfin, l’utilisation de la microscopie à
épifluorescence permet de déterminer la viabilité des microorganismes qui pourraient être encore
présents. Cette dernière étape est très importante. En effet, les normes actuelles permettent de
déterminer macroscopiquement sur gélose nutritive la présence ou l’absence de colonies bactériennes
par dénombrement. Si aucun microorganisme n’est visible à l’œil nu, il est cependant possible que
certains soient encore présents, sans pour autant pouvoir être « cultivés ».

Cette méthodologie peut donc intéresser aussi bien les mondes pharmaceutique, cosmétique,
vétérinaire, alimentaire… .
Elle permet de valider l’efficacité d’un protocole mais aussi de s’assurer de l’efficacité des produits
utilisés, donc de développer des produits avec une activité anti-biofilm réelle, mais aussi de
« screener » aussi des matières premières à potentiel intrinsèque antimicrobien susceptibles d’être
incorporées dans un produit en développement à destination antimicrobienne.
Corinne BENOLIEL
Docteur en Pharmacie
Experte microbiologiste et évaluatrice de la sécurité des produits cosmétiques
www.scientis.fr
Scientis est enregistré comme organisme de formation et dispose de l’agrément Crédit Impôt
Recherche délivré par le Ministère de l’Enseignement Supérieur et de la Recherche.
Cosmétiques-Biocides-Dispositifs médicaux
Formulation, Microbiologie et Réglementation
Inscrivez-vous à notre prochaine formation
09 & 10 mars 2015
Fiche pédagogique 09 mars 2015 - PRODUITS COSMETIQUES
Fiche pédagogique 10 mars 2015 - PRODUITS BIOCIDES et DISPOSITIFS MEDICAUX
Bulletin d'inscription
1
/
4
100%