Contrôle de la température en préhospitalier chez le

Urgences 617
CONTROLE DE LA TEMPERATURE EN
PREHOSPITALIER CHEZ LE TRAUMATISE GRAVE
C. Chollet, F-X. Duchateau, A. Ricard-Hibon, M-F. Bajolet-Laplante, F. Lagneau,
J. Marty, Service d’Anesthésie-Réanimation-SMUR, Hôpital Beaujon, 100 Boulevard
du Général Leclerc, 92110 Clichy, France.
INTRODUCTION
La prise en charge du patient traumatisé grave débute sur les lieux de l’accident et
se poursuit lors de son accueil dans la structure hospitalière. C’est la coexistence à la
fois du caractère urgent de la prise en charge et de la nécessité d’un examen clinique
détaillé qui en fait toute la difficulté. Les mesures initiales et ultérieures de la tempéra-
ture centrale font partie de cet examen initial en raison de la fréquence des anomalies
thermiques observées dans ce contexte et des conséquences physiopathologiques
immédiates et secondaires qui peuvent en résulter. Du fait des facteurs environnemen-
taux, le contrôle de la température en préhospitalier chez les patients traumatisés,
s’oriente préférentiellement vers la prévention et la lutte contre la pérennisation d’une
hypothermie. Des moyens de réchauffement doivent être envisagés systématiquement
et si nécessaire mis en œuvre rapidement.
1. EPIDEMIOLOGIE
1.1. FREQUENCE DES DYSREGULATIONS THERMIQUES
Plusieurs publications ont montré que l’hypothermie était fréquente lors de la prise
en charge de patients polytraumatisés, et qu’elle était probablement sous-estimée dans
la pratique quotidienne [1, 2, 3]. Dans une étude portant sur 89 patients présentant une
hypothermie accidentelle, Rousseau et coll ont observé l’association à un traumatisme
dans 78 % des cas [2]. Luna et coll ont étudié la fréquence de l’hypothermie dans une
étude prospective portant sur 94 patients polytraumatisés : 62 % des patients avaient
une température centrale inférieure à 36°C et 22 % inférieure à 35,4°C[3]. Tazarourte
et coll ont observé dans une étude rétrospective sur 4 ans portant sur 207 traumatisés
crâniens graves que 40 % des patients présentaient une hypothermie et 22 % une
hyperthermie à l’arrivée en réanimation [1].

MAPAR 2002618
1.2. FACTEURS FAVORISANTS CHEZ LE POLYTRAUMATISE
Le patient polytraumatisé est à haut risque d’hypothermie pour de multiples
raisons. L’immobilisation que provoque le traumatisme empêche le patient de se sous-
traire à l’environnement froid et accentue les pertes de chaleur par conduction et
convection. L’existence d’une imprégnation alcoolique fréquente provoque une séda-
tion et une altération de la vasoconstriction périphérique, qui est un mécanisme de lutte
contre l’hyperthermie. Un traumatisme crânien associé peut perturber les mécanismes
d e
régulation thermique. Enfin, la prise en charge médicale tend encore à accroître la
déperdition thermique : examen clinique initial sur un patient découvert, administra-
tion de solutés souvent froids, anesthésie générale.
1.3. INTERET PRONOSTIQUE
Les anomalies thermiques sont associées à une modification du pronostic des
patients. Ainsi, la profondeur de l’hypothermie initiale et l’évolution ultérieure de la
température sont corrélées au pronostic vital du patient [2, 3, 4].
Toutefois, il est difficile de dégager l’imputabilité propre à l’hypothermie dans le
contexte global du polytraumatisme dont le pronostic peut être d’emblée péjoratif.
2. RAPPELS SUR LA REGULATION THERMIQUE
La régulation thermique est la résultante d’une balance entre perte et production de
chaleur. L’adaptation permanente de ces deux phénomènes permet d’obtenir une
température centrale constante dont la valeur est fixée par la commande hypothalami-
que [5]. Conduction, convection, radiation et évaporation sont les quatre phénomènes
physiques qui déterminent la perte de chaleur. La production de chaleur ou la limitation
des pertes résultent de l’augmentation du métabolisme et de modifications du compor-
tement (soustraction de l’environnement froid, refuge dans une ambiance chaude, utili-
sation de couverture). Par ailleurs, des phénomènes visant à limiter la perte de chaleur
peuvent intervenir comme la vasoconstriction des capillaires cutanés.
Le contrôle de ces phénomènes fait intervenir des éléments du système nerveux
central et périphérique ainsi que différents organes effecteurs. Alors que l’hypothala-
mus est lui-même sensible aux variations de température centrale, la perception des
modifications de température périphérique se fait par l’intermédiaire de thermorécep-
teurs situés dans la peau. Le signal électrique généré par ces récepteurs parvient au
cerveau via le faisceau spinothalamique jusqu’au niveau de l’hypothalamus antérieur,
siège du contrôle thermique de l’organisme. Les trois systèmes effecteurs sont le
système nerveux autonome (augmentation de la fréquence cardiaque et du débit cardia-
que, vasoconstriction cutanée), le système neuromusculaire (frissons) et le système
neuroendocrinien via l’hypophyse (sécrétion de TSH et ACTH). Ces systèmes ne sont
pleinement efficients qu’en normothermie voire en hypothermie modérée.
3. CONSEQUENCES PHYSIOPATHOLOGIQUES
Elles sont diverses en fonction de la profondeur de l’hypothermie, considérée
comme mineure de 35 à 32°C, modérée de 32 à 28°C, et profonde au dessous de 28°C[6].
3.1. CONSEQUENCES CARDIOVASCULAIRES
Il y a lieu de distinguer deux niveaux de conséquences. Au cours de la première
phase correspondant à une efficacité des moyens mis en œuvre et se déclenchant pour
des températures comprises entre 35°C et 32°C, on observe classiquement une tachy-

Urgences 619
cardie, une hypertension artérielle systémique, une augmentation du débit cardiaque, et
une polypnée efficace. Au cours de la deuxième phase correspondant aux températures
inférieures à 32°C et à une inefficacité des moyens de régulation, on observe une bra-
dycardie sinusale de plus en plus importante, une baisse du débit cardiaque, une baisse
de la pression artérielle systémique, puis apparaissent des troubles de la conduction
auriculoventriculaire et intraventriculaire (allongement des espaces PR et QT), des trou-
bles de la repolarisation (négativation des ondes T, apparition de l’onde J d’Osborn) et
rapidement une hyperexcitabilité auriculaire et ventriculaire avec risque de fibrillation
ventriculaire [2].
3.2. CONSEQUENCES NEUROLOGIQUES
L’hypothermie entraîne une baisse de la consommation cérébrale d’oxygène
(CMRO2), ce qui, dans certaines conditions peut assurer un certain degré de protection
cellulaire à l’ischémie cérébrale. En dehors de toute prise en charge médicale, l’hypo-
thermie entraîne l’apparition de troubles de la conscience, d’un syndrome cérébelleux,
puis d’un coma accompagné d’une hyporéflexie périphérique et d’une hypoventilation
alvéolaire.
3.3. CONSEQUENCES RESPIRATOIRES
Elles sont liées aux effets directs de l’hypothermie sur le système respiratoire mais
aussi aux conséquences de ses effets sur les autres systèmes, en particulier sur le systè-
me nerveux central (polypnée, bradypnée). La disparition du réflexe de toux et
l’apparition d’une hypersécrétion bronchique sont à l’origine d’un encombrement res-
piratoire parfois sévère pouvant aboutir à des anomalies ventilatoires graves.
3.4. CONSEQUENCES SUR LE MILIEU INTERIEUR
L’hypothermie entraîne une «mise au repos» cellulaire avec pour conséquence une
baisse de la consommation d’oxygène de l’organisme (VO2), une baisse de la produc-
tion de CO2 (VCO2) et donc de la PaCO2, avec initialement une augmentation du pH
artériel [6]. La valeur de l’EtCO2 diminue parallèlement à celle de la PaCO2, mais
l’EtCO2 ne permet pas d’appréhender exactement le niveau de PaCO2 du fait de l’élé-
vation du gradient alvéolo-artériel de CO2[2]. Enfin, sur le transport d’oxygène, il faut
rappeler que l’hypothermie est responsable d’un déplacement de la courbe de dissocia-
tion de l’hémoglobine vers la gauche, et que la limite inférieure tolérable de la saturation
dans ce contexte est supérieure à celle en normothermie [7].
L’hypothermie s’accompagne en outre d’anomalies complexes de l’équilibre acido-
basique. La baisse de la VCO2, isolément, s’accompagne, en l’absence d’adaptation
respiratoire d’une alcalose respiratoire mais les troubles de conscience s’accompagnent
d’une hypoventilation alvéolaire, responsable finalement d’une acidose respiratoire.
D’autre part, le frisson et la mauvaise perfusion tissulaire favorisent l’anaérobiose avec
production de lactates [6].
Par ailleurs, l’hypothermie peut induire une hypokaliémie de redistribution, à res-
pecter car, l’apport de potassium peut s’avérer extrêmement dangereux chez un patient
atteint d’acidose métabolique, de rhabdomyolyse ou d’insuffisance rénale aiguë [7, 8].
La glycémie est, en général, élevée du fait de l’inhibition de la sécrétion d’insuline [6].
Certaines anomalies de la coagulation peuvent également être observées [9].

MAPAR 2002620
4. MONITORAGE DE LA TEMPERATURE EN PREHOSPITALIER
La détection de l’hypothermie peut s’avérer délicate en réanimation préhospitalière
du fait des contraintes environnementales et des moyens diagnostiques limités.
Parmi les moyens de monitorage de la température, on distingue d’une part les ther-
momètres permettant une mesure continue de la température tels que la sonde
œsophagienne connectée à un multiparamètre et d’autre part, les thermomètres à me-
sure discontinue, plus fréquemment utilisés, tels que les thermomètres à dilatation de
liquide, à cristaux liquides et les thermomètres électroniques.
Des études concernant les sites de mesure de la température réalisées au bloc opéra-
toire ont mis en évidence que les sites donnant le meilleur reflet de la température
centrale étaient les sites les plus proches du noyau central comme le tiers inférieur de
l’œsophage, le nasopharynx et l’artère pulmonaire [2, 6, 10]. Les températures rectale,
vésicale et axillaire sont un mauvais reflet de la température centrale du fait d’une plus
grande inertie [11]. En revanche, la prise de la température tympanique semble une
solution particulièrement pertinente lorsqu’elle est réalisée dans de bonnes conditions :
contact direct de la sonde avec le tympan et isolation du conduit auditif externe [11].
Elle est rapide et bien corrélée à la température œsophagienne et pourrait offrir un bon
compromis sécurité/efficacité [2, 12].
Enfin, le monitorage en continu de la température par une sonde œsophagienne est
également facilement utilisable dès la prise en charge préhospitalière chez les patients
intubés [12].
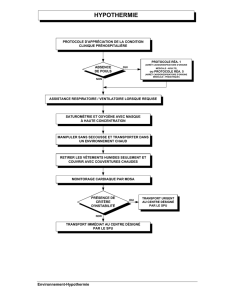
5. PREVENTION ET TRAITEMENT DE L’HYPOTHERMIE
Du fait des facteurs environnementaux, l’hypothermie est pratiquement inévitable
chez le polytraumatisé. Parallèlement à la stabilisation des fonctions vitales, la lutte
contre l’hypothermie fait partie intégrante de la mise en condition du polytrauma-
tisé [14]. Il a été montré dans une étude récente chez le rat, que dans un contexte de
traumatisme associé à un choc hémorragique, la restauration d’une normothermie au
cours de la réanimation améliorait la fonction ventriculaire gauche, le débit cardiaque
et la fonction hépatique [15].
Les moyens disponibles en préhospitalier sont limités. La première mesure consiste
à limiter les déperditions caloriques en soustrayant rapidement le traumatisé à l’am-
biance froide, en l’enveloppant dans une «couverture de survie» après l’avoir déshabillé.
L’installation du patient dans la cellule sanitaire préalablement chauffée du véhicule de
transport est effectuée dès que les conditions le permettent. D’autre part, il y a lieu le
plus souvent de recourir à des techniques de réchauffement actif assuré par un transfert
de chaleur à partir d’une source d’énergie [6]. La mise en place d’une couverture chauf-
fante est facilement réalisable en médecine préhospitalière, même si à ce jour, peu de
SMUR en sont équipés [12].
A la phase initiale du réchauffement actif, une aggravation de l’hypothermie secon-
daire à la vasodilatation périphérique entraînant un afflux de sang refroidi vers le noyau
central peut s’observer. C’est le phénomène d’after drop [6]. Il peut également être
observé lors de mobilisations importantes des patients hypothermes.
Le traumatisé crânien grave constitue un cas particulier. De nombreuses études
expérimentales ont montré une neuroprotection par l’hypothermie en cas d’ischémie
cérébrale. Toutefois, ces effets n’ont jamais été formellement confirmés chez le trau-
matisé crânien en raison de nombreuses difficultés méthodologiques (précocité,
profondeur et durée de l’hypothermie, gestion de la capnie...). Par exemple, Marion et
coll. ont montré que l’induction d’une hypothermie contrôlée et modérée (32 à 33°C)
dans les 10 heures suivant le traumatisme et maintenue pendant 24 heures, améliorait le
pronostic cérébral de ces patients [16]. Mais dans une étude récente portant sur

Urgences 621
392 patients, le même groupe d’étude n’a pas observé de diminution de la mortalité et
des séquelles neurologiques chez des patients ayant bénéficié d’une hypothermie (33°C)
de 24 heures, débutée 4 heures après le traumatisme [17]. Il reste que l’hypothermie
permet d’optimiser l’hémodynamique cérébrale en cas d’HTIC, puisqu’elle inclut une
baisse de la PIC et de la CMRO2 en préservant le DSC [18]. Il convient toutefois de se
méfier des effets secondaires généraux de l’hypothermie tels qu’une dépression myo-
cardique ou une thrombopénie qui ont été rapportées dans ces circonstances à 32,5-33°C
[18]. De même, le frisson qui accroît la production de CO2 par augmentation du méta-
bolisme systémique doit être prévenu au mieux [19].
6. PREVENTION ET TRAITEMENT DE L’HYPERTHERMIE
L’hyperthermie peut survenir chez les traumatisés crâniens graves, et a été attribuée
à une atteinte de l’hypothalamus antérieur [20]. Tazarourte et coll. ont observé que
22% des traumatisés crâniens présentaient une hyperthermie à l’arrivée en salle de
réveil [1]. Dans le cadre de la lutte contre les agressions cérébrales secondaires d’origi-
ne systémique, il convient d’administrer à ces patients un antipyrétique type paracétamol
intraveineux, et ce dès que la température est supérieure ou égale à 38°C.
CONCLUSION
L’hypothermie est fréquente chez le traumatisé grave et ses effets délétères peuvent
apparaître précocement, même lorsqu’elle est modérée. Ce phénomène est trop souvent
considéré
comme accessoire en préhospitalier et de ce fait insuffisament pris en comp-
te. Chez le polytraumatisé, la prise en charge des détresses vitales reste prioritaire, mais
l’identification, la prévention et la lutte contre l’hypothermie doivent faire partie inté-
grante de la prise en charge de ces patients et ce dès la prise en charge préhospitalière.
REFERENCES BIBLIOGRAPHIQUES
[1] Tazarourte K, Rouxel JMP, Leblanc PE, Goix L, Vigné B. Qualité de la prise en charge pré-hospita-
lière des traumatisés crâniens graves en Ile de France. Ann Fr Anesth Réanim 2000;19(suppl 1):312
[2] Rousseau JM, Marsigny B, Cauchy E, Bonsignour JP. Hypothermie en traumatologie. Ann Fr Anesth
Réanim 1997;16:885-94
[3] Luna G.K, Maier R.V, Pavlin E.G. Incidence and effect of hypothermia in seriously injured patients.
J Trauma, 1987;27,9:1014-18
[4] Jurkovich G.J, Greiser W.B, Curreri P.W. Hypothermia in trauma victims: an ominous predictor of
survival, J Trauma, 1987;27,9:1019-24
[5] La température corporelle et sa régulation-La fièvre. In: Guyton, eds. Précis de physiologie médicale.
Italie : Piccin, 1996:798-809
[6] Mantz J, Lasoki S, Fierobe L. Hypothermie accidentelle. In : Sfar, ed. Conférences d’actualisation,
39
e
Congrès national d’anesthésie et de réanimation. Paris:Elsevier, 1997:575-86
[7] Danzl DF, Pozos RS. Accidental hypothermia. N Engl J Med 1994;331:1756-60
[8] Sprung J, Cheng EY, Bosnjak ZJ. Hypothermia and serum potassium concentration [Letter].
Anesthesiology 1991;75:164
[9] Patt A, Mc Croskey BL, Moore EE. Hypothermia-induced coagulopathies in trauma. Surg Clin North
Am 1988:68:775-85
[10] Stone J, Young W, Smith C, Solomon R, Wald A, Ostapkovich N, Shrebnick D. Do standard monito-
ring sites reflect true brain temperature when profound hypothermia is rapidly induced and reversed ?
Anesthesiology 1995;82:344-51
 6
6
1
/
6
100%