Présentation au congrès annuel de l`AACR et publication dans la

Communiqué de presse
____________________________________________________________________________________
POUR DIFFUSION LE 19 AVRIL à 8 h 30 (HNE)
Relations avec les
médias :
Annick Robinson
438 837-2550
Relations avec les
investisseurs :
Justin Holko
908 740-1879
Présentation au congrès annuel de l’AACR et publication dans la revue
New England Journal of Medicine de données sur l’utilisation du pembrolizumab
dans le traitement des formes avancées du cancer du poumon non à petites
cellules (CPNPC)
Kirkland (Québec) – Le 19 avril 2015 – Merck (NYSE : MRK), connue sous le nom de
MSD à l’extérieur des États-Unis et du Canada, a annoncé aujourd’hui de nouvelles données
issues de l’étude KEYNOTE-001, une étude de phase 1b visant à évaluer l’efficacité du
pembrolizumab, le traitement anti-PD-1 expérimental de la société, chez des patients atteints
d’une forme avancée de cancer du poumon non à petites cellules (CPNPC) n’ayant jamais été
traités et chez d’autres ayant déjà été traités. Dans une récente analyse menée auprès de
313 patients et tirée d’un ensemble de données de validation relatives à l’expression du PD-L1
par les cellules tumorales, le taux de réponse globale (TRG) était de 45,4 % (IC à 95 % : 33,5 à
57,3) chez les patients dont le pourcentage de cellules tumorales exprimant le marqueur PD-L1
était supérieur ou égal (≥) à 50 % (n = 73). Dans les autres sous-groupes exprimant le PD-L1, le
TRG était de 16,5 % (IC à 95 % : 9,9 à 25,1) chez les patients dont le pourcentage des cellules
tumorales exprimant le PD-L1 variait de 1 à 49 % (n = 103), et de 10,7 % (IC à 95 % : 2,3 à
28,2) chez ceux dont le pourcentage des cellules tumorales exprimant le PD-L1 était inférieur à
1 % (n = 28). Dans la population totale de l’étude, le TRG était de 19,4 % (IC à 95 % : 16,0 à
23,2) (n = 495), ce qui était conforme aux résultats présentés antérieurement dans le cadre de
cette étude. Ces données, issues de l’étude KEYNOTE-001, seront présentées aujourd’hui par
le Dr Edward Garon, du Jonsson Comprehensive Cancer Center de l’Université de Californie, à
Los Angeles, lors du congrès annuel de l’American Association for Cancer Research (AACR)
(résumé no CT104). Elles faisaient partie du programme officiel de l’AACR, et elles ont
également été publiées aujourd’hui dans la revue New England Journal of Medicine.
Les résultats sur l’efficacité ont démontré que l’expression du PD-L1 par les cellules
tumorales pouvait être un biomarqueur pertinent pour l’identification des patients qui sont

- 2 -
atteints d’un CPNPC et qui sont plus susceptibles de répondre à un traitement anti-PD-1. Le
PD-L1 est une protéine pouvant être surexprimée dans la tumeur et qui peut, d’un point de vue
mécaniste, contribuer à l’inhibition d’une réponse immunitaire.
« Dans cette étude, les patients atteints d’un CPNPC exprimant le PD-L1 dans la
majorité de leurs cellules ont obtenu le taux de réponse au traitement avec le pembrolizumab le
plus élevé », a affirmé le Dr Roger Perlmutter, président, Laboratoires de recherche Merck.
« Les résultats de cette étude indiquent que l’expression du PD-L1 par les cellules tumorales
peut être un biomarqueur pertinent pour identifier les patients plus susceptibles de présenter un
taux plus élevé de réponse. »
Données additionnelles tirées de l’étude KEYNOTE-001 pour l’ensemble de la population
évaluable
Des données sur la survie sans progression (SSP) et la survie globale (SG) selon
l’expression du PD-L1 par les cellules tumorales proviennent également de 356 patients atteints
d’une forme avancée de CPNPC n’ayant jamais été traités et chez d’autres ayant déjà été
traités (total évaluable pour coloration confirmant la présence de PD-L1). Dans le sous-groupe
dont l’expression du PD-L1 était ≥ 50 %, la SSP médiane (IC à 95 %) était de 6,3 mois (2,9 à
12,5) (n = 119); dans ce groupe, le taux de SSP a été de 6,1 mois (2,1 à 12,5) chez les patients
ayant déjà été traités (n = 294) et de 12,5 mois (2,4 à 12,5) chez ceux n’ayant jamais été traités
(n = 62). Le taux de SSP était de 3,3 mois (IC à 95 % : 2,1 à 4,1) dans le sous-groupe dont
l’expression du PD-L1 variait de 1 à 49 % (n = 161) et de 2,3 mois (IC à 95 % : 2,1 à 4,0) dans
celui dont l’expression du PD-L1 était inférieure à 1 % (n = 76). La SG médiane n’avait pas
encore été atteinte dans le sous-groupe dont l’expression du PD-L1 était d’au moins 50 %,
indépendamment du traitement antérieur. La SG médiane a été de 8,8 mois pour les autres
sous-groupes exprimant le PD-L1 (IC à 95 % : 6,8 à 12,4 pour le sous-groupe dont l’expression
du PD-L1 variait de 1 à 49 % et 5,5 à 12 pour celui dont l’expression du PD-L1 était inférieure à
1 %, respectivement) et il était similaire, peu importe le traitement antérieur.
La durée médiane de la réponse au traitement était similaire dans tous les sous-groupes
exprimant le PD-L1; 12,4 mois (2+ à 22,8+) pour le sous-groupe dont l’expression du PD-L1
était d’au moins 50 %, 10,3 mois (1,4+ à 10,3) pour le sous-groupe dont l’expression du PD-L1
variait de 1 à 49 %. La durée médiane de la réponse au traitement n’avait pas été atteinte (0,9+
à 10,8+) dans le sous-groupe dont l’expression du PD-L1 était inférieure à 1 %. Au moment de
l’analyse, la durée médiane du suivi était de 10,9 mois (intervalle de 5,2 à 27,5).
« Ces résultats constituent le plus vaste ensemble de données relatives à un traitement

- 3 -
anti-PD-1 administré à des patients atteints d’une forme avancée de cancer du poumon non à
petites cellules n’ayant jamais été traités et à d’autres ayant déjà été traités. Nous menons un
vaste programme de phase 3 qui permettra de décrire les avantages potentiels du
pembrolizumab, comparativement au traitement de référence chez ces patients », a déclaré
Roger Dansey, directeur du domaine thérapeutique et vice-président principal, développement
en oncologie au stade avancé, Laboratoires de recherche Merck.
Les effets indésirables évalués dans la population totale de l’étude étaient conformes
aux données déjà rapportées sur l’innocuité du pembrolizumab. Les effets indésirables les plus
fréquemment associés au traitement étaient les suivants : fatigue, prurit et diminution de
l’appétit. Des effets indésirables de grades 3 à 5 associés au traitement sont survenus chez
9,5 % des patients (n = 47). Les effets indésirables liés au traitement de nature inflammatoire
ou à médiation immunologique qui sont survenus chez plus de 2 % des patients étaient des
réactions liées à la perfusion (n = 15; 3,0 %), l’hypothyroïdie (n = 34; 6,9 %) et la pneumonite
(n = 18; 3,6 %). Une réaction liée à la perfusion a entraîné l’arrêt du traitement et tous les cas
d’hypothyroïdie ont été traités avec succès au moyen d’un traitement médicamenteux. On
rapporte un décès lié au traitement (pneumonite) et une pneumonite de grades 3 à 5 a été
observée chez 1,8 % des patients (n = 9). Au moment de l’analyse, deux cas de pneumonite
(de grade 1 ou 2) étaient toujours en cours.
À propos de l’étude KEYNOTE-001 et de l’ensemble des données de validation relatives à
l’expression du PD-L1 par les cellules tumorales
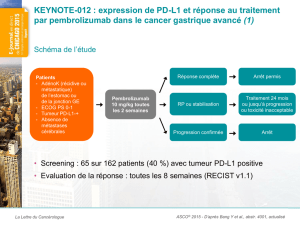
L’étude KEYNOTE-001 est une étude multicentrique de phase 1b, en cours, comportant
un seul groupe et menée au su, visant à évaluer le pembrolizumab chez plus de 1 000 patients
atteints de différents types de cancers à un stade avancé – surtout des cas de cancer du
poumon et de mélanome. Trois schémas posologiques ont été évalués : 10 mg/kg toutes les
deux semaines, 10 mg/kg toutes les trois semaines ou 2 mg/kg toutes les trois semaines. Les
principaux paramètres d’évaluation comprennent notamment le TRG et l’innocuité; les
paramètres secondaires comptent, entre autres, la SSP, la SG et la durée de la réponse. La
réponse tumorale a été évaluée toutes les 9 semaines, selon les critères
d’évaluation RECIST 1.1 (Response Evaluation Criteria in Solid Tumours v1.1) par une revue
des évaluations radiologiques indépendante, centralisée et sous insu. Pour l’ensemble des
données de validation relatives à l’expression du PD-L1 par les cellules tumorales, des
échantillons de tumeurs ont été prélevés simultanément dans les six mois ayant suivi la
coloration. L’expression du PD-L1 par les cellules tumorales a été mesurée au moyen du test

- 4 -
diagnostique compagnon d’immunohistochimie de Dako (PD-L1 IHC 22C3 PharmDx).
L’ensemble des données pour la formation sur l’expression du PD-L1 par les cellules tumorales
issues de l’étude KEYNOTE-001 ont été présentées lors du congrès annuel de l’AACR, en
avril 2014.
À propos du pembrolizumab
Le pembrolizumab est un anticorps monoclonal humanisé qui bloque l’interaction entre
le PD-1 et ses ligands, le PD-L1 et le PD-L2. En se liant au récepteur PD-1 et en bloquant
l’interaction avec ses ligands, le pembrolizumab lève l’inhibition de la réponse immunitaire
médiée par le PD-1, y compris la réponse immunitaire antitumorale.
Merck mène un programme de développement clinique d’envergure et à croissance
rapide pour le pembrolizumab. En effet, ce programme compte plus de 85 études cliniques –
portant sur plus de 30 types de tumeurs et regroupant plus de 14 000 patients – qui évaluent le
médicament tant en monothérapie qu’en association avec d’autres traitements.
À propos du cancer du poumon
Le cancer du poumon, qui se développe dans le tissu pulmonaire, habituellement dans
les cellules tapissant les conduits aériens, est la principale cause de décès lié au cancer dans le
monde. Chaque année, un plus grand nombre de personnes meurent du cancer du poumon
que du cancer du côlon, du sein et de la prostate combinés. Il y a deux types de cancer du
poumon : celui que l’on appelle « non à petites cellules (CPNPC) » et celui dit « à petites
cellules (CPPC) ». Le CPNPC est le type de cancer du poumon le plus répandu et compte pour
environ 85 % de tous les cas. On estime à 4 % le taux de survie relative après 5 ans pour tous
les cas de cancer du poumon à un stade avancé ou métastatique (stade IV) combiné.
Le cancer du poumon est le type de cancer le plus souvent diagnostiqué au Canada (à
l’exception des cancers de la peau autres que le mélanome). Au Canada, il s’agit de la
principale cause de décès lié au cancer, et ce, tant chez les hommes que chez les femmes. En
2014, on a estimé à 26 100 le nombre de Canadiens qui recevraient un diagnostic de cancer du
poumon. Cela représente 14 % de tous les nouveaux cas de cancer en 2014. On a également
estimé que 20 500 Canadiens mourraient du cancer du poumon en 2014. Cela représente 27 %
de tous les décès attribuables au cancer en 2014.
Toujours en 2014, on a estimé que chaque jour, en moyenne, 72 Canadiens recevraient
un diagnostic de cancer du poumon, et 55 Canadiens mourraient des suites de ce type de
cancer1.

- 5 -
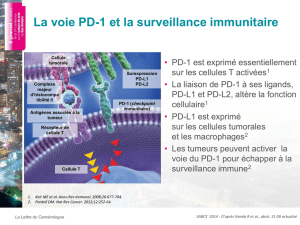
À propos du PD-L1 et de l’expression du PD-L1
Le PD-L1, également appelé « ligand 1 de mort cellulaire programmée », est une
protéine qui est exprimée par de nombreux types de cellules, dont certaines cellules
cancéreuses. Dans des conditions normales, l’interaction du PD-L1 avec une autre protéine,
appelée « récepteur 1 de mort cellulaire programmée (PD-1) », est un important point de
contrôle immunitaire, qui assure le maintien du système immunitaire et qui empêche
l’organisme d’attaquer ses propres cellules si une inflammation ou une infection survient.
Toutefois, lorsque les tumeurs cancéreuses expriment le PD-L1, elles peuvent échapper à la
détection et à la destruction par les lymphocytes T cytotoxiques, un type de cellules qui
détruisent les cellules cancéreuses; c’est ainsi que les tumeurs peuvent survivre et se
développer. L’expression du PD-L1 par les cellules tumorales a été observée à différents
degrés dans de nombreux types de cancers, notamment le cancer du sein, du poumon et de la
vessie. L’expression accrue du PD-L1 par les cellules tumorales, aussi appelée
« surexpression », fait l’objet d’une analyse en vue de son utilisation potentielle pour aider à
identifier les patients plus susceptibles de répondre à certaines immunothérapies.
Notre intérêt pour le cancer
Notre objectif est de traduire les percées scientifiques en innovations biomédicales pour
aider les personnes atteintes du cancer partout dans le monde. Chez Merck Oncologie, aider à
lutter contre le cancer est une passion, favoriser l’accès à nos médicaments contre le cancer
est un engagement et poursuivre la recherche en immuno-oncologie est un idéal pour offrir un
nouvel espoir aux personnes qui sont atteintes d’un cancer. Pour obtenir un complément
d’information sur nos essais cliniques en oncologie, visitez le site à l’adresse
www.merck.com/clinicaltrials.
À propos de Merck
La société Merck d’aujourd’hui est un chef de file mondial dans le domaine des soins de
santé qui œuvre au bien-être du monde. Merck est connue sous le nom de MSD à l’extérieur
des États-Unis et du Canada. Grâce à nos médicaments, vaccins, traitements biologiques,
produits de santé grand public et de santé animale, nous collaborons avec nos clients et
œuvrons dans plus de 140 pays à procurer des solutions de santé novatrices. Nous
démontrons également notre détermination à améliorer l’accès aux soins de santé grâce à des
politiques, programmes et partenariats d’envergure. Pour de plus amples renseignements à
propos de nos activités au Canada, visitez le site www.merck.ca.
 6
6
1
/
6
100%