Comment prédire la réponse à l`immunothérapie

Comment prédire la réponse à l’immunothérapie ?
Julien Adam, MD PhD
Département de Biologie et Pathologie Médicales
INSERM U981
Gustave Roussy, Villejuif

Schalper and Herbst CCR 2016


•Biomarqueur développé en
combinaison aux anti-PD1/PDL1
–Validation dans les essais de phase III
–Sélection des patients en première
ligne ou pour les combinaisons
•Valeur pronostique limitée
•Disponibilité universelle de l’IHC
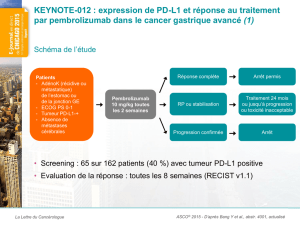
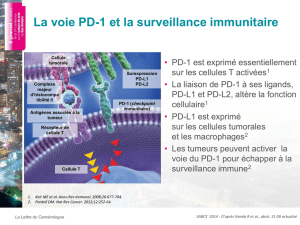
Expression de PD-L1 comme biomarqueur prédictif

PD-L1 IHC assays
Drug Clone Epitope Detection Thresholds FDA status
Nivolumab
(BMS) 28-8
Dako Extracellular EnVision FLEX CT : ≥1%, ≥5%, ≥10% Complementary
diagnostic
(lung, melanoma)
Pembrolizumab
(MSD) 22C3
Dako Extracellular EnVision FLEX CT : ≥1%, ≥50% Companion diagnostic
(lung)
Atezolizumab
(Roche) SP142
Ventana Intracellular OptiView +
amplification CT : ≥1%, ≥5%, ≥50%
CI : ≥1%, ≥5%, ≥10%
Complementary
diagnostic (bladder)
Durvalumab
(AstraZeneca)SP263
Ventana Intracellular OptiView CT : ≥25% -
28-8 22C3 SP142 SP263
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
1
/
36
100%