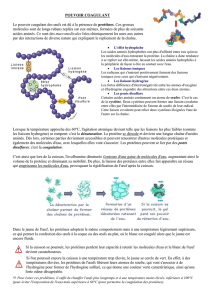
Les constituants biochimiques de l`organisme humain

769785177 - 1 -
L
LE
ES
S
C
CO
ON
NS
ST
TI
IT
TU
UA
AN
NT
TS
S
B
BI
IO
OC
CH
HI
IM
MI
IQ
QU
UE
ES
S
D
DE
E
L
L’
’O
OR
RG
GA
AN
NI
IS
SM
ME
E
H
HU
UM
MA
AI
IN
N
I. NOTIONS DE BASE
A. LES ATOMES
Les atomes sont les plus petites unités de matière qui constituent toutes les
substances chimiques. Ils sont identifiés par un symbole formé d’une ou deux
lettre(s).
ex : H, C, O, Cu, Zn, Fe, …
Les atomes sont eux-mêmes composés de trois éléments encore plus petits : des
particules qui diffèrent par leur masse, leur charge électrique et leur localisation dans
l’atome. Ces particules sont :
- les électrons qui gravitent autour du noyau.
- les protons } qui sont localisés dans
- les neutrons } une structure centrale : le noyau
schéma de l’atome
Les électrons tournent autour du noyau sur des couches périphériques (orbitales) de
plus en plus éloignées du noyau.
Les charges électriques : - électrons – (e-)
- protons + (p+)
- neutrons n’ont pas de charge électrique
Le nombre de protons est égal au nombre d’électrons donc l’atome a une charge
nulle, il est électriquement neutre.
Les atomes sont identifiés par leur nombre atomique, c’est-à-dire leur nombre de
protons (ou d’électrons).
ex : H1 (1 e-, 1 p+)
O8 , N7 , …

769785177 - 2 -
Les protons et les neutrons sont de même masse et sont 2000 fois plus lourds que les
électrons, ainsi la masse de l’atome est quasiment égale à la masse du noyau.
La masse atomique de l’atome est égale à la somme des masses des protons et des
neutrons.
ex : H : 1 e-, 1 p+, 0 neutron masse atomique = 1
C : 6 e-, 6 p+, 6 neutrons masse atomique = 12
document sur l’atome
B. LES MOLECULES
La molécule est l’association de plusieurs atomes réunis grâce à des liaisons
chimiques. La molécule est identifiée par une formule générale qui informe sur le
nombre et le type d’atome.
ex : C6H12O6 glucose
H2O eau (2 atomes d’hydrogène, 1 atome d’oxygène)
Les liaisons chimiques sont des liaisons covalentes établies entre deux atomes
voisins.
Chaque atome cède un électron de sa couche périphérique la plus externe pour établir
une liaison.
ex : eau
Ces liaisons sont de forte énergie, difficiles à rompre. Chaque atome permet de
former un nombre précis de liaisons covalentes en fonction des électrons qu’il
possède sur sa couche la plus externe.
ex : atome H 1 liaison il est monovalent
O 2 liaisons il est bivalent
N 3 liaisons il est trivalent
C 4 liaisons il est tétravalent
Lorsque deux liaisons covalentes s’établissent entre les deux mêmes atomes, on parle
de ‘double liaison’.
La molécule peut se déformer, les atomes peuvent pivoter autour d’une liaison simple
sans la rompre.
Les doubles liaisons ne permettent pas les rotations.
Les molécules ne sont pas planes, elles possèdent des formes tridimensionnelles.
document sur la molécule

769785177 - 3 -
C. LES IONS
De par sa composition, l’atome est électriquement neutre. Il peut subir une
ionisation, c’est-à-dire l’atome peut perdre ou gagner un ou plusieurs électrons.
Dans ce cas, il acquière une charge électrique ; c’est alors un ion.
L’ion est un atome qui a perdu ou gagné un ou plusieurs électrons.
ex : Na Na+
11e- - 1e- 10e-
11p+ 11p+ } excédant de la charge +
Un ion positif est un cation.
ex : Cl Cl-
17e- +1e- 18e-
17p+ 17p+ } excédant de charge –
Un ion négatif est un anion.
L’ionisation consiste à prendre un électron d’un atome et à le transférer à un autre.
On aura ainsi formation d’un anion et d’un cation.
On peut également obtenir des molécules ionisées, surtout pour les groupements
R-COOH R-COO- + H+ et R-NH2 + H+ R-NH3+
Des liaisons ioniques peuvent se former entre deux ions de charge opposée.
ex : sel de table NaCl
Na+ Cl-
liaison ionique
D. LES MOLECULES POLAIRES
La molécule possède des liaisons covalentes (où il y a mise en commun d’électrons).
Les ions possèdent des liaisons ioniques (où il y a un véritable transfert d’électrons).
Il existe aussi des molécules polaires avec leurs liaisons polaires.
Les liaisons polaires sont intermédiaires ; il n’y a pas d’échange réel d’électrons,
c’est une tendance des électrons d’un atome à être attirés par un autre atome.
ex : dans l’eau -O- liaison polaire
+H H+
L’oxygène est légèrement négatif, l’hydrogène est légèrement positif, donc son
électron est attiré par l’atome d’oxygène.
D’autres groupements sont capables de constituer des liaisons polaires.
Ces liaisons polaires sont le plus souvent constituées entre les atomes d’oxygène O et
d’hydrogène H, et entre les atomes d’azote N et d’hydrogène H.
Une molécule sera dite polaire si elle possède un maximum de liaisons polaires et de
liaisons ioniques.

769785177 - 4 -
ex : l’H2O est une molécule polaire car il y a deux liaisons polaires uniquement.
Propriétés :
Si on met en présence plusieurs molécules polaires, il va se créer une attraction entre
les charges – d’un atome (oxygène par exemple) et les charges + d’un autre atome
(hydrogène par exemple). Cette attraction mène à la formation de liaisons hydrogènes
qui sont de faible énergie et facile à casser. Elles se font et se défont en permanence.
ex : l’eau. A basse température, il existe beaucoup de liaisons glace, état figé.
A haute température et température ambiante liquide, état instable.
E. LES SOLUTIONS
Une solution est formée de une ou plusieurs substances chimiques (soluté) dissoutes
dans un liquide (solvant).
Dans l’organisme, le solvant est l’eau.
Attention, toutes les substances ne sont pas solubles dans l’eau. On parle de
solubilité moléculaire : plus une molécule est polaire, plus elle sera attirée par les
molécules d’eau et plus elle sera soluble dans l’eau.
ex : NaCl se dissout dans l’eau car le Cl- et le Na+ seront attirés par les molécules
d’H20 (polaires), ainsi la liaison ionique qui les unit sera cassée.
Les molécules non polaires seront solubles dans des solvants non polaires (ex : huile).
La quantité de substance présente dans une solution s’exprime par sa concentration :
c’est la quantité de substance par unité de volume (par litre).
On peut exprimer la concentration d’une substance en grammes, c’est-à-dire le
nombre de grammes de substance contenue dans un litre de solution (en g/L) : c’est la
concentration massique.
On peut aussi l’exprimer en nombre de molécules de substance par litre de solution
(moles/L) : c’est la concentration molaire.
F. L’ACIDITE
L’acidité d’une solution dépend de sa concentration en ions H+ libres. Plus leur
concentration est importante, plus la solution est acide.
Un acide est une molécule qui peut céder des ions H+.
A l’inverse, les molécules qui peuvent se lier à un ion H+ sont des bases.
L’acidité d’une solution s’exprime par son pH
pH = -log [H+]
pH acide pH neutre pH basique
1 -------------- 7 ------------ 14
solution acide eau pure solution alcaline

769785177 - 5 -
II. PRESENTATION GENERALE DES CONSTITUANTS DE
L’ORGANISME
A. LES PRINCIPAUX ATOMES
1. LES ELEMENTS MAJEURS
Ils représentent la quasi-totalité des atomes de la matière vivante.
LES ELEMENTS ORGANIQUES : ils représentent 99% des atomes de la matière vivante.
C , H , O , N
LES ELEMENTS MINERAUX : ils représentent moins de 1% de la matière vivante.
Na+ , K+ , Cl- , Ca2+ , P- , Mg2+ , S-
2. LES ELEMENTS MINEURS
Ils représentent 0,01% des atomes de la matière vivante. Ce sont des oligo-éléments.
ex : Fe , Cu , Mn , Co , I , …
- Ils sont présents en très faible quantité dans l’organisme.
- L’organisme ne peut pas les synthétiser.
- Ils sont apportés par l’alimentation.
- Les manques en certains oligo-éléments engendrent des problèmes graves.
ex : manque de Fer problème pour fixer l’O2 mort
B. LES PRINCIPALES MOLECULES DE L’ORGANISME HUMAIN
L’EAU est un solvant. Elle représente 60% du poids corporel.
LES CONSTITUANTS ORGANIQUES représentent 35% du poids corporel.
Les atomes sont C , H , O , N ; ils constituent des molécules importantes.
- Les glucides sont des sucres. Ils sont source d’énergie. Ce sont aussi des éléments
de reconnaissance cellulaire. Ils représentent 4% du poids corporel.
- Les lipides sont des graisses. Ce sont des réserves d’énergie, ils ont un rôle
structural. Ils représentent 12% du poids corporel.
- Les protides sont des protéines. Ils ont un rôle structural dans la cellule, et un rôle
métabolique dans la cellule (enzyme, hormone).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%