POUVOIR COAGULANT Le pouvoir coagulant des œufs est dû à la

POUVOIR COAGULANT
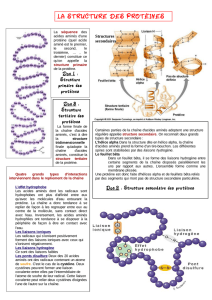
Le pouvoir coagulant des œufs est dû à la présence de protéines. Ces grosses
molécules sont de longs rubans repliés sur eux-mêmes, formées de plus de soixante
acides aminés. Ce sont des macromolécules liées chimiquement les unes aux autres
par des interactions de diverse nature qui expliquent le repliement de la chaîne.
L'effet hydrophobe
Les acides aminés hydrophobes ont plus d'affinité entre eux qu'avec
les molécules d'eau entourant la protéine. La chaîne a donc tendance
à se replier sur elle-même, laissant les acides aminés hydrophiles à
la périphérie de façon à être en contact avec l'eau.
Les liaisons ioniques
Les radicaux qui s'ionisent positivement forment des liaisons
ioniques avec ceux qui s'ionisent négativement.
Les liaisons hydrogène
Les fortes différence d'électronégativité entre les atomes d'oxygène
et d'hydrogène engendre des attractions entre ces deux atomes.
Les ponts disulfure
Certains acides aminés contiennent un atome de soufre. C'est le cas
de la cystéine. Deux cystéines peuvent former une liaison covalente
entre elles par l'intermédiaire de l'atome de soufre de leur radical.
Cette liaison covalente peut relier deux cystéines éloignées l'une de
l'autre sur la chaîne.
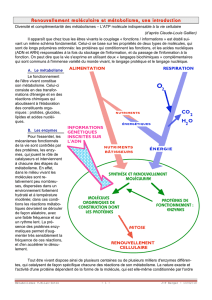
Lorsque la température approche des 60°C, l'agitation atomique devient telle que les liaisons les plus faibles (comme
les liaisons hydrogène) se rompent: c'est la dénaturation. La protéine se déroule et devient une longue chaîne d'acides
aminés. Dès lors, certaines parties deviennent accessibles et peuvent rencontrer d'autres molécules protéiques et
également des molécules d'eau, avec lesquelles elles vont s'associer. Les protéines peuvent se lier par des ponts
disulfures: c'est la coagulation.
C'est ainsi que lors de la cuisson, l'ovalbumine dénaturée s'entoure d'une gaine de molécules d'eau, augmentant ainsi le
volume de la protéine et diminuant sa mobilité. De plus, la liaison des protéines entre elles fait apparaître un réseau
qui emprisonne les molécules d'eau, provoquant la rigidification de l'œuf après la cuisson.
Dans le jaune de l'œuf, les protéines adoptent le même comportement mais à une température légèrement supérieure,
ce qui permet la confection des œufs à la coque ou des œufs au plat, où le blanc est coagulé alors que le jaune est
encore fluide.
Si la cuisson se poursuit, les protéines perdent leur capacité à retenir les molécules d'eau et le blanc de l'œuf
devient caoutchouteux.
Si l'on poursuit encore la cuisson à une température trop élevée, le jaune se cercle de vert. En effet, à des
températures élevées, les protéines de l'œufs libèrent leurs atomes de soufre, qui vont s'associer à de
l'hydrogène pour former de l'hydrogène sulfuré, ce qui donne une couleur verte caractéristique, ainsi qu'une
forte odeur désagréable.
Pour éviter ces problèmes, il suffit de chauffer l'œufs plus longtemps et à une température moins élevée, inférieure à 100°C
(pour éviter l'évaporation de l'eau) mais supérieure à 68°C (pour permettre la coagulation des protéines).
1
/
1
100%